早教吧作业答案频道 -->化学-->
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:(1)配平以下离子方程式,并填上所需的微粒.H++MnO4-+H2C2O4═CO2↑+Mn2++(2)该反应中的
题目详情
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:
(1)配平以下离子方程式,并填上所需的微粒.
___H++___MnO4-+___H2C2O4═___CO2↑+___Mn2++___
(2)该反应中的还原剂是___.
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___mol.
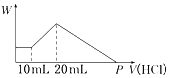
(4)把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
①混合物中NaOH的质量为___g.
②P点表示盐酸的体积是___mL.

(1)配平以下离子方程式,并填上所需的微粒.
___H++___MnO4-+___H2C2O4═___CO2↑+___Mn2++___
(2)该反应中的还原剂是___.
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___mol.
(4)把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
①混合物中NaOH的质量为___g.
②P点表示盐酸的体积是___mL.
▼优质解答
答案和解析
(1)根据元素守恒知,生成物中还含有水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,所以MnO4-、H2C2O4的计量数分别是2、5,再结合原子守恒配平方程式为6H++2MnO4-+5H2C2O4=10CO2↑+2Mn2++8H2O,
故答案为:6;2;5;10;2;8H2O;
(2)失电子化合价升高的反应物H2C2O4是还原剂,发生氧化反应,
故答案为:H2C2O4;
(3)根据MnO4-~5e-得,反应转移了0.4mol电子,则消耗KMnO4的物质的量=
=0.08mol,
故答案为:0.08,
(4)将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中加入盐酸时,0-10mL时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,白色沉淀为Mg(OH)2,加入盐酸10-20mL,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大时,溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,加入20-PmL盐酸,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,溶液中的溶质是氯化铝、氯化镁和氯化钠,
①未加盐酸时的沉淀是氢氧化镁,则n【Mg(OH)2】=
=0.01mol,根据Mg原子守恒得n(MgCl2)=n【Mg(OH)2】=0.02mol,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=0.5mol/L×(0.02-0.01)L=0.005mol,根据铝原子守恒得n(AlCl3)=n(AlO2-)=0.005mol,沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.005mol×3+0.02L×0.5mol/L=0.045mol,m(NaOH)=0.045mol×40g/mol=1.8g,
故答案为:1.8;
②P点溶质是氯化铝、氯化镁和氯化钠,所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量为:n(HCl)=n(NaOH),沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.005mol×3+0.02L×0.5mol/L=0.045mol,
所以P点加入盐酸的体积为:
=0.09L=90mL,
故答案为:90.
故答案为:6;2;5;10;2;8H2O;
(2)失电子化合价升高的反应物H2C2O4是还原剂,发生氧化反应,
故答案为:H2C2O4;
(3)根据MnO4-~5e-得,反应转移了0.4mol电子,则消耗KMnO4的物质的量=
| 0.4mol |
| 5 |
故答案为:0.08,
(4)将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中加入盐酸时,0-10mL时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,白色沉淀为Mg(OH)2,加入盐酸10-20mL,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大时,溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3,加入20-PmL盐酸,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,溶液中的溶质是氯化铝、氯化镁和氯化钠,
①未加盐酸时的沉淀是氢氧化镁,则n【Mg(OH)2】=
| 0.58g |
| 58g/mol |
故答案为:1.8;
②P点溶质是氯化铝、氯化镁和氯化钠,所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量为:n(HCl)=n(NaOH),沉淀最大时,溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.005mol×3+0.02L×0.5mol/L=0.045mol,
所以P点加入盐酸的体积为:
| 0.045mol |
| 0.5L |
故答案为:90.
看了医学上常用酸性高锰酸钾溶液和草...的网友还看了以下:
下列各组中,含的离子晶体、分子晶体、原子晶体各一种的是()A.B.金刚石、C.HF、SiC、ArD 2020-04-09 …
下列各组中,含的离子晶体、分子晶体、原子晶体各一种的是()A.KCl、H2SO4、SB.金刚石、N 2020-04-09 …
在校课外活动小组的同学分别对四种溶液中所含的离子进行检测,下列所得结果,有错误的是A、K+、Na+ 2020-04-26 …
英语句子分析ThefirsttimeIateBritishfoodIwasinthecanteen 2020-05-13 …
下列说法中,不正确的是()A.离子晶体中不一定含有金属离子B.在含有阳离子的化合物的晶体中,一定含 2020-05-14 …
在质量分数为50%的酒精(分子式为C2H5O)溶液中。1.酒精和水物质的量之比为()2.()mol 2020-05-15 …
多少克的硫酸所含分子数于3.65G10%盐酸溶液中所含的离子数相同 2020-05-21 …
下列成语或俗语包含的一定的化学原理,请你选择其中之二从化学角度作出解释.“钻木取火、煽风点火、釜底 2020-06-20 …
现有甲、乙两种溶液,共含有8种离子,分别为H+、Ag+、K+、Ba2+、OH-、Cl-、NO3-和 2020-06-22 …
自由组合定律包含分离定律吗是不是自由组合定律只说多对分离组合互不影响而没说基因会分离这一性质 2020-07-26 …