早教吧作业答案频道 -->化学-->
工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4.即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,其生产工艺简略如
题目详情
工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4.即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,其生产工艺简略如下:
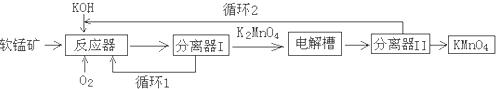
(1)反应器中反应的化学方程式为___.
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量___ (填“偏高”或“偏低”).
(3)电解槽中阳极的电极反应方程式为___.
(4)在传统工艺中得到K2MnO4后,向其中通入CO2反应生成黑色固体、KMnO4等,反应的化学反应方程式为___.根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为___.与该传统工艺相比,电解法的优势是___.
(5)用高锰酸钾测定某草酸结晶水合物的纯度:称量草酸晶体样品0.250g溶于水,用0.0500mol•L-1的酸性KMnO4溶液滴定(杂质不反应),至溶液呈浅粉红色且半分钟内不褪去,消耗KMnO4溶液15.00mL,则该草酸晶体的纯度为___.(已知该草酸结晶水合物H2C2O4•2H2O的式量为126)

(1)反应器中反应的化学方程式为___.
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量___ (填“偏高”或“偏低”).
(3)电解槽中阳极的电极反应方程式为___.
(4)在传统工艺中得到K2MnO4后,向其中通入CO2反应生成黑色固体、KMnO4等,反应的化学反应方程式为___.根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为___.与该传统工艺相比,电解法的优势是___.
(5)用高锰酸钾测定某草酸结晶水合物的纯度:称量草酸晶体样品0.250g溶于水,用0.0500mol•L-1的酸性KMnO4溶液滴定(杂质不反应),至溶液呈浅粉红色且半分钟内不褪去,消耗KMnO4溶液15.00mL,则该草酸晶体的纯度为___.(已知该草酸结晶水合物H2C2O4•2H2O的式量为126)
▼优质解答
答案和解析
(1)二氧化锰和氢氧化钾、氧气发生反应,生成锰酸钾和水,Mn(+4→+6),O(0→-2),反应的化学方程式为4KOH+2MnO2+O2=2K2MnO4+2H2O,
故答案为:4KOH+2MnO2+O2=2K2MnO4+2H2O;
(2)氧化铝是两性氧化物,既能与强酸反应也能与强碱反应,氧化铝和强碱反应生成偏铝酸盐和水,反应的化学方程式为2KOH+Al2O3=2KAlO2+H2O,所以会导致KOH消耗量偏高,
故答案为:偏高;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,即MnO42--e-=MnO4-,
故答案为:MnO42--e-=MnO4-;
(4)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3,由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3份锰参加反应生成2份KMnO4,所以KMnO4的产率最高为
×100%=66.7%,与该传统工艺相比,电解法阳极都生成KMnO4,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;66.7%;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.05mol/L×15.0×10-3L
解得n(H2C2O4•2H2O)=1.875×10-3mol
则m(H2C2O4•2H2O)=1.875×10-3mol×126g/mol=0.236g,所以成品的纯度ω=
×100%=94.5%,
故答案为:94.5%.
故答案为:4KOH+2MnO2+O2=2K2MnO4+2H2O;
(2)氧化铝是两性氧化物,既能与强酸反应也能与强碱反应,氧化铝和强碱反应生成偏铝酸盐和水,反应的化学方程式为2KOH+Al2O3=2KAlO2+H2O,所以会导致KOH消耗量偏高,
故答案为:偏高;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,即MnO42--e-=MnO4-,
故答案为:MnO42--e-=MnO4-;
(4)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3,由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3份锰参加反应生成2份KMnO4,所以KMnO4的产率最高为
| 2 |
| 3 |
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;66.7%;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.05mol/L×15.0×10-3L
解得n(H2C2O4•2H2O)=1.875×10-3mol
则m(H2C2O4•2H2O)=1.875×10-3mol×126g/mol=0.236g,所以成品的纯度ω=
| 0.236g |
| 0.25g |
故答案为:94.5%.
看了工业上以软锰矿(主要成分MnO...的网友还看了以下:
计算:(1)a•a5-(2a3)2+(-2a2)3(2)先化简(a-2ab-b2a)•a2+aba 2020-05-01 …
已知A2-离子中含有x个中子,A元素的质量数为m,则n克A2-离子共含有电子的物质的量为(单位为摩 2020-05-13 …
向量a模=b模=1,a与b夹角为60度,向量c=xb+yb,面积且0小于等于x小于等于1,0小于等 2020-05-14 …
6a(m-n)^2-8(n-m)^3分解因式怎么分解呀6m(m-n)²-8(n-m)³ 2020-05-20 …
正方形ABCD中,AB=m,AC=n,面积为S.得结论:1.S=n^2/22.m/n=√2/23. 2020-05-22 …
已知M={2,a,b}N={2a,2b^2}且N=M.求ab∵N=M∴2a=a或2a=b若2a=a 2020-05-22 …
因式分解-7(m-n)63+2(n-m)^2-28(n-m)^3打错-7(m-n)^2+2(n-m 2020-06-03 …
设函数f(x)=(-2^x+m)/(2^x+n)(m,n为常数,且m∈正整数,n∈R)若f(x)是 2020-06-09 …
1.试着说明5^33-5^31一定能被120整除2.mn(m-n)-m(n-m)^23.24(m- 2020-08-01 …
计算(1)(14)0×4-2(2)(-2a)3-(-a)(3a)2(3)(m-n)2•(n-m)3• 2020-10-31 …