早教吧作业答案频道 -->化学-->
实验室以绿矾(FeSO4•7H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2CH2COO)2Fe].有关物质性质:甘氨酸(NH2CH2COOH)柠檬酸甘氨酸亚铁易溶于水,微溶于乙醇、两性化合物易溶
题目详情
实验室以绿矾(FeSO4•7H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2CH2COO)2Fe].有关物质性质:
实验过程:
I.制备FeCO3:将0.10mol绿矾于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO)2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.
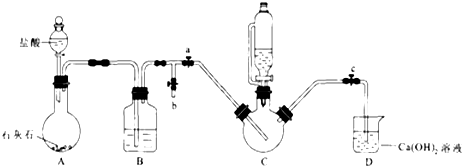
回答下列问题:
(1)实验I中:铁粉的作用是___;生成沉淀的离子方程式为___.
(2)实验II中:
①装置B中试剂为___.
②当C中空气排净后,应停止滴加盐酸,打开止水夹___,关闭止水夹___
③装置D中Ca(OH)2的作用是___.
④柠檬酸可调节pH,体系pH与产率的关系如下表:
pH过低使产率下降的原因是___;柠檬酸的作用还有___(填序号).
a.作反应终点指示剂 b.防止二价铁被氧化
c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是___.
⑥若产品的质量为m g,则产率为___.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):___.(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2O2定量快速氧化.)
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
I.制备FeCO3:将0.10mol绿矾于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO)2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.

回答下列问题:
(1)实验I中:铁粉的作用是___;生成沉淀的离子方程式为___.
(2)实验II中:
①装置B中试剂为___.
②当C中空气排净后,应停止滴加盐酸,打开止水夹___,关闭止水夹___
③装置D中Ca(OH)2的作用是___.
④柠檬酸可调节pH,体系pH与产率的关系如下表:
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
a.作反应终点指示剂 b.防止二价铁被氧化
c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是___.
⑥若产品的质量为m g,则产率为___.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):___.(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2O2定量快速氧化.)
▼优质解答
答案和解析
(1)二价铁具有较强的还原性,在制备碳酸亚铁的过程中,为了防止二价铁被氧化,需加入少量铁粉,绿矾的水溶液与NH4HCO3溶液反应的方程式为 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:防止二价铁被氧化;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)①由于稀盐酸与石灰质制备二氧化碳的过程中,HCl有挥发性,为了避免挥发出的HCl干扰后续试验,故需除去,可选用饱和NaHCO3溶液,
故答案为:饱和NaHCO3溶液;
②当C中空气排净后,应停止滴加盐酸,制备产物,此过程不需要二氧化碳,需要控制左侧的物质不能进入右侧的反应装置,故硬关闭止水夹b,打开止水夹a,故答案为:b;a;
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽,若产生沉淀则需要继续除空气,以免对实验造成干扰,
故答案为:判断装置中控器是否排尽;
④pH过低使产率下降的原因是H+会与NH2CH2COOH中的氨基反应,柠檬酸有强酸性和还原性,作用还有促进FeCO3溶解,防止二价铁被氧化,故答案为:H+会与NH2CH2COOH反应;bc;
⑤由于甘氨酸亚铁易溶于水,难溶于乙醇,故乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度,
故答案为:降低甘氨酸亚铁在水中的溶解度,提高产率和纯度;
⑥根据原子守恒,绿矾中的铁元素为0.10mol,过程中NH4HCO3溶液过量,故根据铁原子守恒知理论上产生[(NH2 CH2COO)2 Fe0.10mol,其质量为20.4g,故产率=
=
,故答案为:
;
(3)测定产品中二价铁含量,称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次,可根据消耗的高锰酸钾的量计算二价铁的量,
故答案为:称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
故答案为:防止二价铁被氧化;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)①由于稀盐酸与石灰质制备二氧化碳的过程中,HCl有挥发性,为了避免挥发出的HCl干扰后续试验,故需除去,可选用饱和NaHCO3溶液,
故答案为:饱和NaHCO3溶液;
②当C中空气排净后,应停止滴加盐酸,制备产物,此过程不需要二氧化碳,需要控制左侧的物质不能进入右侧的反应装置,故硬关闭止水夹b,打开止水夹a,故答案为:b;a;
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽,若产生沉淀则需要继续除空气,以免对实验造成干扰,
故答案为:判断装置中控器是否排尽;
④pH过低使产率下降的原因是H+会与NH2CH2COOH中的氨基反应,柠檬酸有强酸性和还原性,作用还有促进FeCO3溶解,防止二价铁被氧化,故答案为:H+会与NH2CH2COOH反应;bc;
⑤由于甘氨酸亚铁易溶于水,难溶于乙醇,故乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度,
故答案为:降低甘氨酸亚铁在水中的溶解度,提高产率和纯度;
⑥根据原子守恒,绿矾中的铁元素为0.10mol,过程中NH4HCO3溶液过量,故根据铁原子守恒知理论上产生[(NH2 CH2COO)2 Fe0.10mol,其质量为20.4g,故产率=
| 实际产量 |
| 理论产量 |
| m |
| 20.4 |
| m |
| 20.4 |
(3)测定产品中二价铁含量,称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次,可根据消耗的高锰酸钾的量计算二价铁的量,
故答案为:称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
看了实验室以绿矾(FeSO4•7H...的网友还看了以下:
三氯化铁电解电解三氯化铁水溶液,阴极和阳极各产生什么,三价铁离子得电子能力排在哪里? 2020-05-17 …
高中化学求助氢氧化铁的溶解度小于氢氧化镁,能说氢氧化铁的ksp就小于氢氧化镁吗?! 2020-05-17 …
氧化铁为什么不跟硫酸铜反应为什么氧化铁不跟硫酸铜反应?我经常误以为会反应~是不是其它金属氧化物也有 2020-05-17 …
在汉代许多著作里有记载“石胆能化铁为铜”,可见我国劳动人民很早就认识了铜盐溶液里的铜能被铁置换,此 2020-06-19 …
用所学的化学知识回答(1)氯化铁水溶液常温时的pH7(填“>”、“=”)原因是(用离子方程式表示) 2020-06-28 …
下列说法正确的是()①多数金属氧化物、氢氧化物不溶于水②多数不溶于水的金属氢氧化物可与酸反应,生成 2020-07-05 …
已知25℃时,氢氧化铁的溶解平衡常数是2.79×10Λ-39.那么该温度下反应Fe(OH)3+H已 2020-07-17 …
为什么向氯化铁水溶液中通入过量的氯化氢气体可以抑制氯化铁的水解呢?而不是促进水解? 2020-07-21 …
高二化学来人!向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白 2020-07-22 …
为了除去溶液中以离子形态存在的铁杂质,最好生成氢氧化铁,为什么 2020-11-22 …