早教吧作业答案频道 -->化学-->
决定物质性质的重要因素是物质结构,请回答下列问题:(1)某Cr的配合物K[Cr(C2O4)2(H2O)2]中,配体有种,配位原子是;与C2O42-互为等电子体的分子是(填化学式);(2)CaO晶胞
题目详情
决定物质性质的重要因素是物质结构,请回答下列问题:
(1)某Cr的配合物K[Cr(C2O4)2(H2O)2]中,配体有___种,配位原子是___;与C2O42-互为等电子体的分子是(填化学式)___;
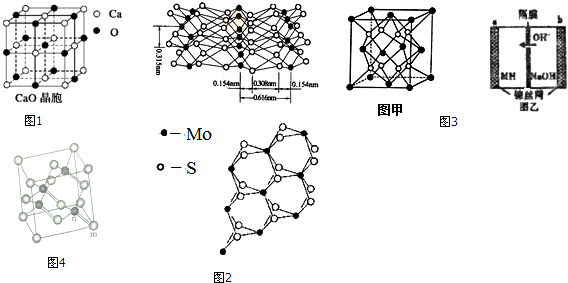
(2)CaO晶胞如图1所示,CaO晶体和NaCl晶体的晶格能分别为:CaO:3401kJ/mol、NaCl:786kJ/mol. 导致两者晶格能差异的主要原因___.
(3)汽车安全气囊的产生药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,在NaN3固体中,阴离子的立体构型为___.
(4)从不同角度观察MoS2的晶体结构见图2,已知:Mo元素基态原子的价电子排布式为4d55s1.
①下列说法正确的是___
A.晶体硅中硅原子的轨道杂化类型为sp2
B.电负性:C<S
C.晶体硅和C60比较,熔点较高的是C60
D.Mo位于第五周期VIB族
E.MoS2的晶体中每个Mo原子周围距离最近的S原子数目为4
F.MoS2的晶体中Mo-S之间的化学键为极性键、配位键、范德华力
②根据MoS2的晶体结构回答:MoS2纳米粒子具有优异的润滑性能,其原因是___
(5)铁和镁组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3甲(黑球代表铁,白球代表镁).则该化学式为___,若该合金用M表示,某中储氢镍电池(MH-Ni电池)的结构如图3乙所示.其电池反应为:MH+NiOOH=Ni(OH)2+M.下列有关说法不正确的是___.
A.放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+OH--e-=═H2O+M
D.M的储氢密度越大.电池的比能量越高
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图4,晶胞参数α=565pm.砷化镓的晶胞密度=___g/cm3(列式并计算),m位置Ga原子与n位置As原子之间的距离为___pm(列式表示).
(1)某Cr的配合物K[Cr(C2O4)2(H2O)2]中,配体有___种,配位原子是___;与C2O42-互为等电子体的分子是(填化学式)___;
(2)CaO晶胞如图1所示,CaO晶体和NaCl晶体的晶格能分别为:CaO:3401kJ/mol、NaCl:786kJ/mol. 导致两者晶格能差异的主要原因___.

(3)汽车安全气囊的产生药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,在NaN3固体中,阴离子的立体构型为___.
(4)从不同角度观察MoS2的晶体结构见图2,已知:Mo元素基态原子的价电子排布式为4d55s1.
①下列说法正确的是___
A.晶体硅中硅原子的轨道杂化类型为sp2
B.电负性:C<S
C.晶体硅和C60比较,熔点较高的是C60
D.Mo位于第五周期VIB族
E.MoS2的晶体中每个Mo原子周围距离最近的S原子数目为4
F.MoS2的晶体中Mo-S之间的化学键为极性键、配位键、范德华力
②根据MoS2的晶体结构回答:MoS2纳米粒子具有优异的润滑性能,其原因是___
(5)铁和镁组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3甲(黑球代表铁,白球代表镁).则该化学式为___,若该合金用M表示,某中储氢镍电池(MH-Ni电池)的结构如图3乙所示.其电池反应为:MH+NiOOH=Ni(OH)2+M.下列有关说法不正确的是___.
A.放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+OH--e-=═H2O+M
D.M的储氢密度越大.电池的比能量越高
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图4,晶胞参数α=565pm.砷化镓的晶胞密度=___g/cm3(列式并计算),m位置Ga原子与n位置As原子之间的距离为___pm(列式表示).
▼优质解答
答案和解析
(1)某Cr的配合物K[Cr(C2O4)2(H2O)2]中,配体为C2O42-、H2O,配体中O原子含有孤对电子,
原子数目相等、价电子总数相等的微粒互为等电子体,1个C原子与1个负电荷可以用N原子替换,与C2O42-互为等电子体的分子为N2O4,
故答案为:2;O;N2O4;
(2)晶体中阴阳离子所带电荷数CaO大于NaCl,所以CaO的晶格能大于NaCl的,
故答案为:晶体中阴阳离子所带电荷数CaO大于NaCl;
(3)在NaN3固体中阴离子为N3-,与CO2互为等电子体,结构相似,为直线形结构,
故答案为:直线形;
(4)①A.晶体硅中每个硅原子和4个硅原子能形成4个共价键,所以每个硅原子含有4个σ键且不含孤电子对,含有4个共价键的原子采用sp3杂化,故A错误;
B.元素的非金属性越强其电负性越大,S元素的非极性大于C元素,所以电负性:CC.硅晶体属于原子晶体,C60晶体中存在分子间作用力,所以硅晶体熔点高于C60,故C错误;
D.Mo元素基态原子的价电子排布式为4d55s1,位于第五周期VIB族,故D正确;
E.根据图知,每个Mo原子周围距离最近的S原子数目是6,故E错误;
F.提供空轨道和提供孤电子对的原子间易形成配位键,配位键属于共价键,不同元素之间易形成的配位键属于极性共价键,范德华力不属于化学键,故F错误;
故答案为:BD;
②MoS2结构和石墨相似,根据图片知,MoS2具有层状结构,Mo和S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动,
故答案为:MoS2具有层状结构,Mo与S同层间以共价键结合,层与层之间通过范德华力结合,在外力作用下层与层间易发生相对滑动;
(5)根据均摊法可知,晶胞中Fe原子数目为8×
+6×
=4,Mg原子数目为8,故化学式为:Mg2Fe,
A.放电时正极发生还原反应,反应为NiOOH+H2O+e-=Ni(OH)2+OH-,故A正确;
B.为b为正极,a为负极,电子由负极通过导线流向正极,故B错误;
C.充电时为电解池,两极名称为阳极、阴极,放电时负极发生氧化反应,反应为:MH+OH--e-=M+H2O,故C错误;
D.M为储氢合金,储氢材料氢密度越大,电池的比能量密度越高,故D正确,
故答案为:Mg2Fe;BC;
(6)m位置Ga原子,n位置As原子,晶胞中含有Ga原子数为8×
+6×
=4,As原子数目为4,晶胞质量为:4×
g,则晶胞密度为4×
g÷(565×10-10 cm)3=5.34g.cm-3,
Ga原子与As原子之间的距离应为晶胞体对角线长度的
倍,所以晶胞的体对角线为晶胞棱长的
倍,则m位置Ga原子与n位置As原子之间的距离为
×565 pm,
故答案为:4×
÷(565×10-10 )3=5.34;
×565.
原子数目相等、价电子总数相等的微粒互为等电子体,1个C原子与1个负电荷可以用N原子替换,与C2O42-互为等电子体的分子为N2O4,
故答案为:2;O;N2O4;
(2)晶体中阴阳离子所带电荷数CaO大于NaCl,所以CaO的晶格能大于NaCl的,
故答案为:晶体中阴阳离子所带电荷数CaO大于NaCl;
(3)在NaN3固体中阴离子为N3-,与CO2互为等电子体,结构相似,为直线形结构,
故答案为:直线形;
(4)①A.晶体硅中每个硅原子和4个硅原子能形成4个共价键,所以每个硅原子含有4个σ键且不含孤电子对,含有4个共价键的原子采用sp3杂化,故A错误;
B.元素的非金属性越强其电负性越大,S元素的非极性大于C元素,所以电负性:C
D.Mo元素基态原子的价电子排布式为4d55s1,位于第五周期VIB族,故D正确;
E.根据图知,每个Mo原子周围距离最近的S原子数目是6,故E错误;
F.提供空轨道和提供孤电子对的原子间易形成配位键,配位键属于共价键,不同元素之间易形成的配位键属于极性共价键,范德华力不属于化学键,故F错误;
故答案为:BD;
②MoS2结构和石墨相似,根据图片知,MoS2具有层状结构,Mo和S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动,
故答案为:MoS2具有层状结构,Mo与S同层间以共价键结合,层与层之间通过范德华力结合,在外力作用下层与层间易发生相对滑动;
(5)根据均摊法可知,晶胞中Fe原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
A.放电时正极发生还原反应,反应为NiOOH+H2O+e-=Ni(OH)2+OH-,故A正确;
B.为b为正极,a为负极,电子由负极通过导线流向正极,故B错误;
C.充电时为电解池,两极名称为阳极、阴极,放电时负极发生氧化反应,反应为:MH+OH--e-=M+H2O,故C错误;
D.M为储氢合金,储氢材料氢密度越大,电池的比能量密度越高,故D正确,
故答案为:Mg2Fe;BC;
(6)m位置Ga原子,n位置As原子,晶胞中含有Ga原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 70+75 |
| 6.02×1023 |
| 70+75 |
| 6.02×1023 |
Ga原子与As原子之间的距离应为晶胞体对角线长度的
| 1 |
| 4 |
| 3 |
| ||
| 4 |
故答案为:4×
| 70+75 |
| 6.02×1023 |
| ||
| 4 |
看了决定物质性质的重要因素是物质结...的网友还看了以下:
AB4型分子,若A分子为氢分子,那B可以是,答案上写的说B元素的最外层电子数应为4,那是不是ABn 2020-04-11 …
关于乙炔分子结构疑问乙炔分子中的4原子在一条直线上问:是什么决定了乙炔的4原子是直线排布而不是其他 2020-04-12 …
下列有关分子、原子和离子的说法正确的是()A.保持氮气化学性质的粒子是氮分子B.原子的质子数决定元 2020-05-13 …
在2012年伦敦奥运会中,牙买加选手博尔特是一公认的世界飞人,在男子100m决赛和男子200m决赛 2020-07-12 …
在2008北京奥运会中,牙买加选手博尔特(如图)是一公认的世界飞人,在男子100m决赛和男子200 2020-07-17 …
在1012年伦敦奥运会中,牙买加“闪电”博尔特是公认的世界飞人,在男子100m决赛和男子200m决赛 2020-12-01 …
在2008年北京奥运会中,牙买加选手博尔特是公认的世界飞人,在男子100m决赛和男子200m决赛中, 2020-12-10 …
在2012年伦敦奥运会中,牙买加选手博尔特是一公认的世界飞人,在男子100m决赛和男子200m决赛中 2020-12-10 …
在2008北京奥运会中,牙买加选手博尔特是一公认的世界飞人,在男子100m决赛和男子200m决赛中分 2020-12-10 …
如图所示,博尔特在男子100m决赛和男子200m决赛中分别以9.69s和19.30s的成绩破两项世界 2020-12-22 …