早教吧作业答案频道 -->化学-->
Ⅰ.在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;(1)在恒容条件下该反应达到化学平衡状态的依据是(选填序号).a.
题目详情
Ⅰ.在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
(1)在恒容条件下该反应达到化学平衡状态的依据是___(选填序号).
a.υ(H2):υ(N2)=3:1
b.n(N2):n(NH3)=1:2
c.c(H2):c(NH3)=3:2
d.容器内压强保持不变
(2)反应达到平衡后,某时刻改变下列条件___,在达到新平衡的过程中正反应速率始终增大.
a.升温 b.加压 c.增大c(N2) d.降低c(NH3)
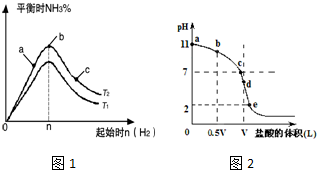
(3)某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图1所示:(图中T2和T1表示温度,n表示起始时H2的物质的量)
①图象中T2和T1的关系是:T2___T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是___(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为___ mol•L-1.
Ⅱ.常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图2图象回答下列问题:
(1)比较b、c、d三点时的溶液中,水电离的c(OH-)由大到小的顺序为___.
(2)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有___.
a.
b.
c.
d.
(3)该温度时氨水的电离平衡常数K=___.

(1)在恒容条件下该反应达到化学平衡状态的依据是___(选填序号).
a.υ(H2):υ(N2)=3:1
b.n(N2):n(NH3)=1:2
c.c(H2):c(NH3)=3:2
d.容器内压强保持不变
(2)反应达到平衡后,某时刻改变下列条件___,在达到新平衡的过程中正反应速率始终增大.
a.升温 b.加压 c.增大c(N2) d.降低c(NH3)
(3)某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图1所示:(图中T2和T1表示温度,n表示起始时H2的物质的量)
①图象中T2和T1的关系是:T2___T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是___(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为___ mol•L-1.
Ⅱ.常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图2图象回答下列问题:
(1)比较b、c、d三点时的溶液中,水电离的c(OH-)由大到小的顺序为___.
(2)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有___.
a.
| c(NH4+) |
| c(NH3•H2O) |
| c(H+) |
| c(OH-) |
| c(NH4+)•c(OH-) |
| c(NH3•H2O) |
| c(NH3•H2O)•c(H+) |
| c(NH4+) |
(3)该温度时氨水的电离平衡常数K=___.
▼优质解答
答案和解析
I.(1)a.没有明确正逆速率,不能确定是否处于平衡状态,若分别为正逆速率则处于平衡状态,故a错误;
b.平衡时氮气、氨气的物质的量关系与氮气的转化率有关,平衡时可能为1:2,也可能不是1:2,故b错误;
c.平衡时氢气、氨气的浓度关系与氢气转化率有关,故c错误;
d.正反应为气体物质的量减小的反应,随反应进行,压强减小,容器内压强保持不变说明到达平衡,故d正确,
故选:d;
(2)a.升温温度,瞬间正逆速率都增大,正反应为放热反应,逆反应速率增大较大,平衡向逆反应移动,逆反应速率减小、正反应速率增大至平衡,在达到新平衡的过程中正反应速率始终增大,故a符合;
b.加压,瞬间正逆反应速率都增大,正反应为气体体积减小的反应,正反应速率增大较大,平衡向正反应移动,正反应速率减小、逆反应速率增大至平衡,故b不符合;
c.增大c(N2),瞬间正反应增大、逆反应速率不变,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故c不符合;
d.降低c(NH3),瞬间正反应速率不变,逆反应速率减小,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故d不符合,
故选:a;
(3)①由图可知,n(H2)相同时,温度T2对应氨气含量高,反应为放热反应,降低温度有利于生成氨气,则T21 ,故答案为:<;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,c点时氢气的物质的量最大,c点N2的转化率最高,故答案为:c;
③n=0.15molH2,起始体系中加入0.05molN2,反应达到平衡时H2的转化率为60%,则转化的氢气为0.09mol,则:
N2(g)+3H2(g)⇌2NH3(g)
开始(mol):0.05 0.15 0
变化(mol):0.03 0.09 0.06
平衡(mol):0.02 0.06 0.06
故氮气的平衡浓度为
=0.02mol/L,故答案为:0.02;
Ⅱ.(1)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为:d>c>b,
故答案为:d>c>b;
(2)滴定时,由b点到c点的过程中,碱性减弱,酸性增强,
a.
=
,由b点到c点的过程中,c(OH-)不断减小,故该值增大,故a不符合;
b.由b点到c点的过程中,c(H+)不断增大,c(OH-)不断减小,
的值逐渐减小,故b不符合;
c.
为一水合氨的电离平衡常数,只与温度有关,滴定过程中不变,故c符合;
d.
是铵根离子水解平衡常数,只与温度有关,滴定过程中不变,故d符合;
故选:cd;
(3)未加HCl时,氨水浓度为0.1mol/L,溶液的pH=11,则溶液中c(OH-)=
mol/L=0.001mol/L,水的电离程度较小,溶液中c(OH-)≈c(NH4+),一水合氨电离程度较小,则c(NH3.H2O)≈0.1mol/L,氨水的电离平衡常数K=
=
=10-5,
故答案为:10-5.
b.平衡时氮气、氨气的物质的量关系与氮气的转化率有关,平衡时可能为1:2,也可能不是1:2,故b错误;
c.平衡时氢气、氨气的浓度关系与氢气转化率有关,故c错误;
d.正反应为气体物质的量减小的反应,随反应进行,压强减小,容器内压强保持不变说明到达平衡,故d正确,
故选:d;
(2)a.升温温度,瞬间正逆速率都增大,正反应为放热反应,逆反应速率增大较大,平衡向逆反应移动,逆反应速率减小、正反应速率增大至平衡,在达到新平衡的过程中正反应速率始终增大,故a符合;
b.加压,瞬间正逆反应速率都增大,正反应为气体体积减小的反应,正反应速率增大较大,平衡向正反应移动,正反应速率减小、逆反应速率增大至平衡,故b不符合;
c.增大c(N2),瞬间正反应增大、逆反应速率不变,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故c不符合;
d.降低c(NH3),瞬间正反应速率不变,逆反应速率减小,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故d不符合,
故选:a;
(3)①由图可知,n(H2)相同时,温度T2对应氨气含量高,反应为放热反应,降低温度有利于生成氨气,则T2
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,c点时氢气的物质的量最大,c点N2的转化率最高,故答案为:c;
③n=0.15molH2,起始体系中加入0.05molN2,反应达到平衡时H2的转化率为60%,则转化的氢气为0.09mol,则:
N2(g)+3H2(g)⇌2NH3(g)
开始(mol):0.05 0.15 0
变化(mol):0.03 0.09 0.06
平衡(mol):0.02 0.06 0.06
故氮气的平衡浓度为
| 0.02mol |
| 1L |
Ⅱ.(1)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为:d>c>b,
故答案为:d>c>b;
(2)滴定时,由b点到c点的过程中,碱性减弱,酸性增强,
a.
| c(NH4+) |
| c(NH3•H2O) |
| Kb(NH3.H2O) |
| c(OH-) |
b.由b点到c点的过程中,c(H+)不断增大,c(OH-)不断减小,
| c(H+) |
| c(OH-) |
c.
| c(NH4+)•c(OH-) |
| c(NH3•H2O) |
d.
| c(NH3•H2O)•c(H+) |
| c(NH4+) |
故选:cd;
(3)未加HCl时,氨水浓度为0.1mol/L,溶液的pH=11,则溶液中c(OH-)=
| 10-14 |
| 10-11 |
| c(NH4+)•c(OH-) |
| c(NH3•H2O) |
| 10-3×10-3 |
| 0.1 |
故答案为:10-5.
看了Ⅰ.在某温度时按n(N2):n...的网友还看了以下:
恒温恒容,化学反应平衡时,加入一种反应物,化学平衡怎么移动?恒温恒容,化学反应平衡时,加入一种反应 2020-05-14 …
如果地球自转方向不变,公转方向相反,恒星日和太阳日的周期为多少?(请看清楚问题,我只要答案) 2020-06-04 …
曰岱华松恒衡三字经中是什么意思 2020-06-10 …
嵩恒衡怎么读 2020-07-02 …
含“恒”“衡”“横”的成语,最好可以用来形容人的 2020-07-05 …
选择合适的字组词。横恒衡平()永()()行 2020-07-28 …
锅炉正平衡效率和反平衡效率允许差多少锅炉热力计算时需要校核,相对误差多少在允许范围内? 2020-08-02 …
对对子,才子才女对一下啊很恨了无痕横风狠恒心涟漪衡高手们娱乐一下,对对看。注意:很恨痕横狠恒衡 2020-11-10 …
材料一1978年以来我国基尼系数变化情况年份1978年1990年1994年1996年2005年200 2020-12-11 …
2.假若地球绕日公转方向与地球自转方向相反,恒星日的长度与太阳日相比会如何?(麻烦说详细点,我地理不 2020-12-14 …