早教吧作业答案频道 -->化学-->
研究含氮污染物的治理是环保的一项重要工作.合理应用和处理氮的化合物,在生产生活中有重要意义.(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-12C(s)+O2(g)═2CO(g)△H=-221.0
题目详情
研究含氮污染物的治理是环保的一项重要工作.合理应用和处理氮的化合物,在生产生活中有重要意义.
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=___ kJ•mol-1,利于
该反应自发进行的条件是___(选填“高温”或“低温”).
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图1所示:
①反应从开始到9min时,用CO2表示该反应的速率是___(保留2位有效数字)
②第12min时改变的条件是___(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为___(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将___移动(填“正向”、“逆向”或“不”).
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在t1时刻达到平衡状态的是___(填序号).
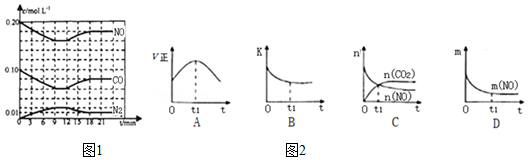
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为___.
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=___ kJ•mol-1,利于
该反应自发进行的条件是___(选填“高温”或“低温”).
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图1所示:
①反应从开始到9min时,用CO2表示该反应的速率是___(保留2位有效数字)
②第12min时改变的条件是___(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为___(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将___移动(填“正向”、“逆向”或“不”).
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在t1时刻达到平衡状态的是___(填序号).

(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为___.
▼优质解答
答案和解析
(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律③×2-②-①可知:则汽车尾气处理的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=(-393.5kJ•mol-1)-(-221.0kJ•mol-1)-(180.5kJ•mol-1)=-746.5KJ/mol,2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0,正反应气体体积减小,△S<0,反应能自发进行,应满足△H-T•△S<0,需低温下进行,
故答案为:-746.5KJ/mol;低温;
(2)①反应从开始到9min时,图象分析可知一氧化碳浓度变化为0.04mol/L,二氧化碳生成浓度为0.04mol/L,用CO2表示该反应的速率=
mol/(L•min)≈0.0044mol/(L•min),
故答案为:0.0044mol/(L•min);
②图象分析可知12min后一氧化氮和一氧化碳浓度增大,氮气浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化,
故答案为:升温;
③依据图象分析,18min时平衡状态下物质的浓度为c(NO)=0.18mol/L,c(CO)=0.08mol/L,c(N2)=0.01mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,2NO(g)+2CO(g)⇌N2(g)+2CO2(g),K=
=
;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=
=0.044>K,平衡逆向进行,
故答案为:
;逆向;
(3)A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确,
故答案为:BD;
(4)碱性燃料电池中,负极上燃烧失电子发生氧化反应,所以该原电池中负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律③×2-②-①可知:则汽车尾气处理的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=(-393.5kJ•mol-1)-(-221.0kJ•mol-1)-(180.5kJ•mol-1)=-746.5KJ/mol,2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0,正反应气体体积减小,△S<0,反应能自发进行,应满足△H-T•△S<0,需低温下进行,
故答案为:-746.5KJ/mol;低温;
(2)①反应从开始到9min时,图象分析可知一氧化碳浓度变化为0.04mol/L,二氧化碳生成浓度为0.04mol/L,用CO2表示该反应的速率=
| 0.04 |
| 9 |
故答案为:0.0044mol/(L•min);
②图象分析可知12min后一氧化氮和一氧化碳浓度增大,氮气浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化,
故答案为:升温;
③依据图象分析,18min时平衡状态下物质的浓度为c(NO)=0.18mol/L,c(CO)=0.08mol/L,c(N2)=0.01mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,2NO(g)+2CO(g)⇌N2(g)+2CO2(g),K=
| C(CO2)C(N2) |
| C2(NO)C2(CO) |
| 0.022×0.01 |
| 0.182×0.082 |
| 0.022×0.07 |
| 0.182×0.142 |
故答案为:
| 0.022×0.01 |
| 0.182×0.082 |
(3)A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确,
故答案为:BD;
(4)碱性燃料电池中,负极上燃烧失电子发生氧化反应,所以该原电池中负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
看了研究含氮污染物的治理是环保的一...的网友还看了以下:
为括号部分发音相同的单词归类st(ay)m(ee)tn(o)d(ow)nr(oo)ml(oo)kt 2020-05-14 …
关于力的分解1.已知AO,BO为轻绳,AO与BO垂直,小球的重力为G,求小球的重力在O点产生的两个 2020-05-17 …
英语单词辨音找出画()部分读音与其余不同的单词()1.A .kn(ee) B.n(e)ck C.r 2020-05-17 …
判断下列各组单词括号内部分发音是否相同.h(o)td(o)g()cl(o)ckc(o)ffee() 2020-06-26 …
基础闯关全练水滴石穿全面过关?答案P1311.下列加点字的注音有误的一项是()A.耸立(sǒng) 2020-07-02 …
.下列词语中,加点的字读音全部正确的一组是()A.东皋(gǎo)迤(yǐ)逦央浼(měi)少不更( 2020-07-02 …
下列各项中字音不正确的一项是:()A.涕(tì)泪梯(tī)子府第(dì)B.饿莩(fú)俘(fú 2020-07-12 …
A.耸立(sǒng)缭绕(liáo)冰镐(gǎo)B.石膏(gāo)摄影(shè)陡滑(dǒu)C. 2020-11-10 …
选出加点字注音有误的一项()A.耸(sǒng)立石膏(gāo)海滨(bīn)B.匍(pú)匐缭(li 2020-11-10 …
算法复杂度计算中Max{f,g}=O(f+g)是否正确?如果正确的话错误的话请举例.注意,需要证明的 2021-01-14 …