早教吧作业答案频道 -->化学-->
钼酸钠晶体(Na2MoO4•2H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图1所示:(1)钼和锆同属过渡金属,锆元素
题目详情
钼酸钠晶体( Na2MoO4•2H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图1所示:
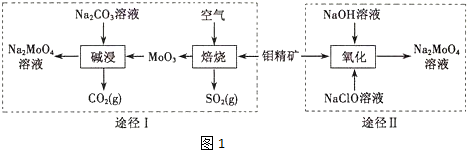
(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是___(填序号)
A.锆合金比纯锆的熔点高,硬度小
B.二氧化锆陶瓷属于新型无机非金属材料
C.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为___.
②途径Ⅱ氧化时发生反应的离子方程式为___.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是___.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:
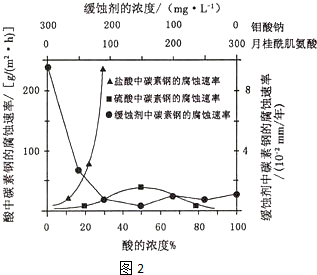
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为___.
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是___.
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2
Lix(MoS2)n.则电池放电时的正极反应式是:___.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO4•2H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为___L(用x、M、n表示,并化为最简)

(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是___(填序号)
A.锆合金比纯锆的熔点高,硬度小
B.二氧化锆陶瓷属于新型无机非金属材料
C.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为___.
②途径Ⅱ氧化时发生反应的离子方程式为___.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是___.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为___.
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是___.
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2
| 放电 |
| |
| 充电 |
▼优质解答
答案和解析
(1)A.合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点 低于组成它的成分金属的熔点,所以锆合金比纯锆的熔点低,硬度大,故A错误;
B.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故B正确;
C.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故C错误;
故答案为:B;
(2)①途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,故答案为:MoO3+CO32-=MoO42-+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3,故答案为:(NH4)2CO3或(NH4)2SO3;
(4)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(5)放电时,正极应是发生还原反应的,从总反应式中找到发生还原反应的物质为MoS2,而被还原的产物为Lix(MoS2)n,则电极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n,a克的Na2MoO4•2H2O(分子量为M)中Mo的物质的量为
mol,途径I用Lix(MoS2)n,被空气氧化成MoO3,根据电子得失守恒有关系式
O2~nMoO3,所以需要需要空气(含O2为20%)在标况下的体积为
×
÷50%÷20%×22.4L=
L,
故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;
.
B.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故B正确;
C.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故C错误;
故答案为:B;
(2)①途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,故答案为:MoO3+CO32-=MoO42-+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3,故答案为:(NH4)2CO3或(NH4)2SO3;
(4)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(5)放电时,正极应是发生还原反应的,从总反应式中找到发生还原反应的物质为MoS2,而被还原的产物为Lix(MoS2)n,则电极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n,a克的Na2MoO4•2H2O(分子量为M)中Mo的物质的量为
| a |
| M |
| 14n+x |
| 4 |
| 14n+x |
| 4n |
| a |
| M |
| 56(14n+x)a |
| nM |
故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;
| 56(14n+x)a |
| nM |
看了钼酸钠晶体(Na2MoO4•2...的网友还看了以下:
下列加线字注音全正确的一项是A.怄气(òu)窥望(guī)聒噪(guō)怨怅(chàng)B.麾军 2020-05-15 …
21、如图,用同样规格黑白两色的正方形瓷砖铺设长方形地面,请观察下列图形,(1)设铺设地面所用瓷砖 2020-05-16 …
如图,用同样规格的黑白两色的正方形瓷砖铺设矩形地面,请观察下列图形的规律,(1)在第n如图,用同样 2020-05-16 …
下面是一些火柴棒拼出的一系列图形第n个图形由n个正方形组成,通过观察图形:①用n表示火柴棒根数S; 2020-05-17 …
下列词语中加点字的读音完全正确完全一项是()A.剽悍(biāo)哂笑(shěn)拈轻怕重(niān 2020-07-03 …
如图所示,已知正n边形A1A2A3.An,在n边形内任取一点O连接OA,OA1,OA2.,OAn, 2020-08-01 …
将正整数按如图所示排列,用有序数对对(n,m)表示n牌,左到右排列第m个数,如(4,4)表示10图: 2020-10-30 …
用火柴棒按下图的方式搭图形:(1)填写下表:图形编号123…火柴棒根数…(2)按这样的图式搭火柴棒, 2020-12-05 …
给下列划线的字注音正确的一项是()A.潜伏(qián)掮客(jiān)潜泳(qiǎn)倩影(qiàn 2020-12-09 …
下列加点字注音,全部正确的一组是()A.殷红(yīn)戕害(qiānɡ)矜持(jīnɡ)忌惮(dàn 2020-12-18 …