早教吧作业答案频道 -->化学-->
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能.如图是化工生产中制备金属钼的主要流程图
题目详情
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能.如图是化工生产中制备金属钼的主要流程图.
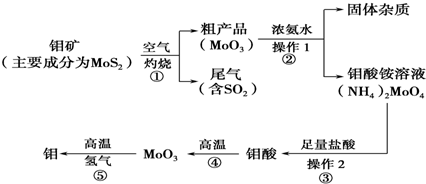
(1)反应①的尾气可以用NH3•H2O溶液吸收合成肥料,写出反应的离子方程式___.
(2)钼酸铵溶液中的主要阳离子的检验方法:___.
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有___.
(4)写出反应①的化学方程式:___.
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4
2CO+2H2,CH4+H2O
CO+3H2.含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为___.

(1)反应①的尾气可以用NH3•H2O溶液吸收合成肥料,写出反应的离子方程式___.
(2)钼酸铵溶液中的主要阳离子的检验方法:___.
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有___.
(4)写出反应①的化学方程式:___.
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4
| 高温 |
| |
| 高温 |
| |
▼优质解答
答案和解析
辉钼矿(主要成分是MoS2)在空气中燃烧生成MoO3和SO2,二氧化硫属于酸性氧化物,能被碱液吸收,所以尾气含SO2用浓氨水吸收,二氧化硫具有还原性,则同时通入氧气生成硫酸铵;MoO3加浓氨水生成钼酸铵溶液,过滤除去杂质,在钼酸铵溶液中加足量盐酸,发生复分解反应生成钼酸和氯化铵,钼酸为难溶于水和酸的黄色晶体,过滤得到钼酸晶体高温分解生成MoO3,在高温条件下用氢气还原得到金属钼,
(1)二氧化硫和一水合氨反应生成亚硫酸铵,离子反应方程式为2NH3•H2O+SO2═2NH4++SO32-+H2O,故答案为:2NH3•H2O+SO2═2NH4++SO32-+H2O;
(2)铵根离子检验方法为:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子,
故答案为:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子;
(3)如果在实验室模拟操作1和操作2,该操作为过滤,过滤时需要的玻璃仪器有烧杯、漏斗和玻璃棒,
故答案为:烧杯、漏斗和玻璃棒;
(4)高温下,MoS2和O2发生氧化还原反应生成MoO3和SO2,反应方程式为2MoS2+7O2
2MoO3+4SO2,
故答案为:2MoS2+7O2
2MoO3+4SO2;
(5)根据CO2+CH4
2CO+2H2、CH4+H2O
CO+3H2知,生成(CO+H2)体积是消耗甲烷体积的4倍,CO和氢气还原MoO3制钼时,每个分子CO和H2失去电子数相同,
含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,则甲烷转化的物质的量=
=0.0321amol,
则生成CO和氢气物质的量之和为0.1284amol,
根据转移电子守恒得生成Mo的质量=
×96g/mol=4.11ag,
故答案为:4.11a g.
(1)二氧化硫和一水合氨反应生成亚硫酸铵,离子反应方程式为2NH3•H2O+SO2═2NH4++SO32-+H2O,故答案为:2NH3•H2O+SO2═2NH4++SO32-+H2O;
(2)铵根离子检验方法为:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子,
故答案为:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子;
(3)如果在实验室模拟操作1和操作2,该操作为过滤,过滤时需要的玻璃仪器有烧杯、漏斗和玻璃棒,
故答案为:烧杯、漏斗和玻璃棒;
(4)高温下,MoS2和O2发生氧化还原反应生成MoO3和SO2,反应方程式为2MoS2+7O2
| ||
故答案为:2MoS2+7O2
| ||
(5)根据CO2+CH4
| 高温 |
| 高温 |
含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,则甲烷转化的物质的量=
| aL×80%×90% |
| 22.4L/mol |
则生成CO和氢气物质的量之和为0.1284amol,
根据转移电子守恒得生成Mo的质量=
| 0.1284amol×2 |
| 6 |
故答案为:4.11a g.
看了钼是一种过渡金属元素,通常用作...的网友还看了以下:
英文厉害的来帮忙啊.拉乌盖茨瘸跛这3个单词要可以用英语连贯起来love??还是LOVETHAT'S. 2020-03-31 …
方、向、木、土这四个字加个偏旁,四个都要可以用,想想哦 2020-05-17 …
英文翻译器哪有下载? 急!要可以用的 2020-05-17 …
培养优秀的金融理财人员,主要可采用的人才选拔和培养方法包括( )。Ⅰ.内部工作人员优先提拔制度Ⅱ. 2020-05-22 …
根据银行情况主要可选用以下哪几种方式进行票据业务查询:( )A.系统查询B.实地查询C.传真查询 2020-05-27 …
INtess客服平台中VP台主要可以用来实现的功能()? 2020-05-31 …
单字反义词,要可以用来当情侣名的像晨,夜这样,有点内涵D,有点困难, 2020-06-10 …
求英语手抄报的推荐版式myroom也求内容我实在不会画,最好有图,文字也可以、、速求啊、、可以不要很 2020-11-07 …
下列实验操作中错误的是()A.过滤操作时如果有必要可以用蒸馏水洗涤滤纸上的沉淀2-3次B.蒸馏操作时 2020-12-02 …
一道高难度数学题用4个"0"计算,结果=24.(当然要可以用高等数学)我记得是可以的,在电视中(三星 2020-12-16 …