早教吧作业答案频道 -->化学-->
碳酸锰,俗称“锰白”,是生产电讯器材软磁铁氧体的原料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,工业上有广泛的用途.工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)
题目详情
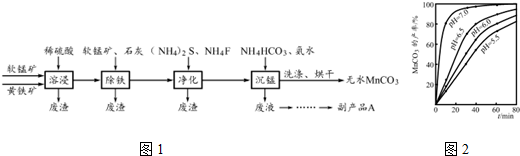
碳酸锰,俗称“锰白”,是生产电讯器材软磁铁氧体的原料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,工业上有广泛的用途.工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如图1:
已知:几种金属离子沉淀的pH如表回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有___.
A.适当升高温度 B.适当增大压强
C.研磨矿石 D.加入大量的蒸馏水
(2)溶浸过程中发生的主要反应是:FeS2与MnO2在稀硫酸中反应生成Fe3+、Mn2+、SO42-和H2O.在该反应配平的离子方程式中,氧化剂前面的化学计量数为___.
(3)除铁工序中,①先加入软锰矿,反应的离子方程式为___;
②再加入石灰的目的是___.
(4)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(Fˉ)=0.01mol•L-1,滤液中残留c(Ca2+)=1.5×10ˉ6mol•L-1,则Ksp(CaF2)=___.
(5)沉锰工序中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液的pH、反应时间关系如图2所示.对比不同反应条件下的曲线,依据图中信息,你能获得的结论有:
①pH等于7.0时反应速率最快,且MnCO3产率最高;②___.
(6)副产品A的主要成分是___.

已知:几种金属离子沉淀的pH如表回答下列问题:
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
A.适当升高温度 B.适当增大压强
C.研磨矿石 D.加入大量的蒸馏水
(2)溶浸过程中发生的主要反应是:FeS2与MnO2在稀硫酸中反应生成Fe3+、Mn2+、SO42-和H2O.在该反应配平的离子方程式中,氧化剂前面的化学计量数为___.
(3)除铁工序中,①先加入软锰矿,反应的离子方程式为___;
②再加入石灰的目的是___.
(4)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(Fˉ)=0.01mol•L-1,滤液中残留c(Ca2+)=1.5×10ˉ6mol•L-1,则Ksp(CaF2)=___.
(5)沉锰工序中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液的pH、反应时间关系如图2所示.对比不同反应条件下的曲线,依据图中信息,你能获得的结论有:
①pH等于7.0时反应速率最快,且MnCO3产率最高;②___.
(6)副产品A的主要成分是___.
▼优质解答
答案和解析
软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液PH,使铁离子全部沉淀,过滤得到浸出液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到硫酸铵,滤渣为碳酸锰,通过洗涤、烘干得到硫酸锰晶体,
(1)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,
故答案为:AC;
(2)FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,作还原剂,1molMnO2得到2mol电子,作氧化剂,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,所以氧化剂前面的计量数为15,
故答案为:15;
(3)除铁工序中,①先加入适量的软锰矿,使残余Fe2+转化为Fe3+,便于将铁离子沉淀,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,②由表中数据可知三价铁离子完全的沉淀的PH为3.7,铜离子开始沉淀的范围为5.2,所以加入石灰调节溶液的pH的范围为3.7~5.2,
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;3.7~5.2;
(4)根据题中提供的数据可知,Ksp(CaF2)=c2(F-)•c(Ca2+)=(0.01mol•L-1)2×1.5×10ˉ6mol•L-1=1.5×10ˉ10(mol3•L-3),
故答案为:1.5×10ˉ10(mol3•L-3);
(5)根据MnCO3的产率与溶液pH、反应时间关系如图可知:pH等于7.0时反应到达平衡所用时间最短,即反应速率最快,且MnCO3产率最高,所以pH越大越有利于提升MnCO3的产率,
故答案为:pH越大越有利于提升MnCO3的产率;
(6)溶浸过程中发生的反应生成硫酸根离子,后来又加入了硫化铵、碳酸氢铵,所以产品中含有(NH4)2SO4,
故答案为:(NH4)2SO4.
(1)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,
故答案为:AC;
(2)FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,作还原剂,1molMnO2得到2mol电子,作氧化剂,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,所以氧化剂前面的计量数为15,
故答案为:15;
(3)除铁工序中,①先加入适量的软锰矿,使残余Fe2+转化为Fe3+,便于将铁离子沉淀,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,②由表中数据可知三价铁离子完全的沉淀的PH为3.7,铜离子开始沉淀的范围为5.2,所以加入石灰调节溶液的pH的范围为3.7~5.2,
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;3.7~5.2;
(4)根据题中提供的数据可知,Ksp(CaF2)=c2(F-)•c(Ca2+)=(0.01mol•L-1)2×1.5×10ˉ6mol•L-1=1.5×10ˉ10(mol3•L-3),
故答案为:1.5×10ˉ10(mol3•L-3);
(5)根据MnCO3的产率与溶液pH、反应时间关系如图可知:pH等于7.0时反应到达平衡所用时间最短,即反应速率最快,且MnCO3产率最高,所以pH越大越有利于提升MnCO3的产率,
故答案为:pH越大越有利于提升MnCO3的产率;
(6)溶浸过程中发生的反应生成硫酸根离子,后来又加入了硫化铵、碳酸氢铵,所以产品中含有(NH4)2SO4,
故答案为:(NH4)2SO4.
看了碳酸锰,俗称“锰白”,是生产电...的网友还看了以下:
市场上某补钙剂的主要成份是碳酸钙(化学式:CaCO3)请计算(要求写计算过程):(1)碳酸钙的相对 2020-04-11 …
英语翻译客人对这个订单又要求修改了,原来的XX还是需要2台.另外还需要新增一个AA,客人也承诺我这 2020-04-11 …
水垢主要成分是碳酸钙和氢氧化镁测定水垢中碳酸钙的含量,将足量质量分数为14.6%的盐酸加入到20. 2020-05-16 …
白云石主要成分是碳酸钙和碳酸镁的混合物白云石遇酸遇碱分别有什么反应?白云石为三方晶系,化学成份为C 2020-05-17 …
怎样选择电阻功率?比如:电路最大电流2安,需要串20欧电阻.电阻功率是否要(2×2×20)瓦.选大 2020-05-17 …
碳酸钠和碳酸氢钠都是生活中常见的盐,碳酸氢钠是干粉灭火器中干粉的主要成分之一.回答下列问题:(1)碳 2020-11-16 …
理想是石敲出星星之火开头为希望是.仿写2句根据理想是石敲出星星之火仿写开头必须是希望是.(要2句) 2021-01-04 …
计算12g碳在足量的氧气中燃烧生成二氧化碳的质量1.在本题中,已知碳的质量是12g,要求()的质量、 2021-01-21 …
计算12g碳在足量的氧气中燃烧生成二氧化碳的质量1.在本题中,已知碳的质量是12g,要求()的质量、 2021-01-21 …
二氧化碳是重要的资源,具有广泛的用途.(1)二氧化碳可用于生产碳酸饮料,其中发生反应的化学方程式为3 2021-02-19 …