早教吧作业答案频道 -->化学-->
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某研究小组尝试回收废旧正极材料中的钴.(1)25℃时,用图1所示装置进行电解,有
题目详情
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某研究小组尝试回收废旧正极材料中的钴.
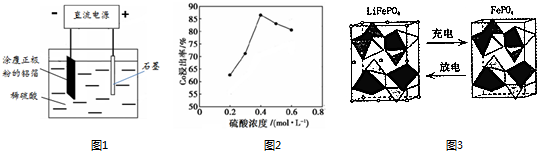
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离.
①阴极的电极反应式为:LiCoO2+4H++e-═Li++Co2++2H2O、___.阳极的电极反应式为___.
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示.当c(H2SO4)>0.4mol•L-1时,钴的浸出率下降,其原因可能为___.
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部.用以下步骤继续回收钴(如图).
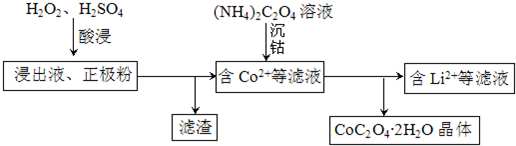
写出“酸浸”过程中正极粉发生反应的化学方程式___.该步骤一般在80℃以下进行,温度不能太高的原因是___.
(3)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g•mol-1)的质量分数为a%,则回收后得到CoC2O4•2H2O(M=183g•mol-1)的质量不高于___g.
(4)LiFePO4电池是另一种锂离子电池,某电极的工作原理如图3所示:该电池电解质为传导Li+的固体材料.放电时该电极是电池的___(填“正”或“负”)极,放电时的电极反应式为___.
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离.
①阴极的电极反应式为:LiCoO2+4H++e-═Li++Co2++2H2O、___.阳极的电极反应式为___.
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示.当c(H2SO4)>0.4mol•L-1时,钴的浸出率下降,其原因可能为___.
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部.用以下步骤继续回收钴(如图).

写出“酸浸”过程中正极粉发生反应的化学方程式___.该步骤一般在80℃以下进行,温度不能太高的原因是___.
(3)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g•mol-1)的质量分数为a%,则回收后得到CoC2O4•2H2O(M=183g•mol-1)的质量不高于___g.
(4)LiFePO4电池是另一种锂离子电池,某电极的工作原理如图3所示:该电池电解质为传导Li+的固体材料.放电时该电极是电池的___(填“正”或“负”)极,放电时的电极反应式为___.

▼优质解答
答案和解析
(1)①H+也会在阴极放电生成氢气:2H++2e-═H2↑;氢氧根离子在阳极放电生成氧气,电极反应式为:4OH--4e-═O2↑+2H2O,
故答案为:2H++2e-═H2↑;4OH--4e-═O2↑+2H2O;
②如图2所示.当c(H2SO4)>0.4mol•L-1时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降,
故答案为:H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降;
(2)“酸浸”过程中正极粉发生还原反应,过氧化氢发生氧化反应,反应生成LiSO4、CoSO和O2,反应方程式为:2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O;该步骤一般在80℃以下进行,温度太高,双氧水会受热分解;
故答案为:2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O;温度太高,双氧水会受热分解;
(3)根据Co原子守恒,则:
LiCoO2~CoC2O4•2H2O
98 183
xa%g m
解之得m=
,
故答案为:
;
(4)放电过程是FePO4转化为LiFePO4,应是锂离子获得电子,发生还原反应,为电池的正极,电极反应式为:FePO4+Li++e-=LiFePO4,
故答案为:正;FePO4+Li++e-=LiFePO4.
故答案为:2H++2e-═H2↑;4OH--4e-═O2↑+2H2O;
②如图2所示.当c(H2SO4)>0.4mol•L-1时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降,
故答案为:H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降;
(2)“酸浸”过程中正极粉发生还原反应,过氧化氢发生氧化反应,反应生成LiSO4、CoSO和O2,反应方程式为:2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O;该步骤一般在80℃以下进行,温度太高,双氧水会受热分解;
故答案为:2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O;温度太高,双氧水会受热分解;
(3)根据Co原子守恒,则:
LiCoO2~CoC2O4•2H2O
98 183
xa%g m
解之得m=
| 1.83ax |
| 98 |
故答案为:
| 1.83ax |
| 98 |
(4)放电过程是FePO4转化为LiFePO4,应是锂离子获得电子,发生还原反应,为电池的正极,电极反应式为:FePO4+Li++e-=LiFePO4,
故答案为:正;FePO4+Li++e-=LiFePO4.
看了某种锂离子电池的正极材料是将含...的网友还看了以下:
回答有关生物多样性和生物进化的问题:研究者对某山坡不同海拔高度生物群落的分布进行了研究.经历了3年 2020-06-10 …
(2014•南通二模)玉兔号月球车登陆月球后,对月面进行巡视勘察.(1)月球车机械臂前端有一“岩芯 2020-06-18 …
某研究性学习小组的同学认为“保护环境,人人有责”,他们在课外活动时对“二氧化硫能否与水反应生成酸” 2020-06-22 …
(2004•安徽)某班学生在野炊时用石灰石堆成简易灶台做饭.野炊后有同学从灶台内侧敲下几小块石片, 2020-06-28 …
某研究小组利用伊乐藻进行了光合作用影响因素的研究.实验结果如下表,请回答问题:pH伊乐藻生物量�某 2020-07-02 …
某研究小组对柑橘园中的蚯蚓进行了专题研究.回答下列有关问题:(1)蚯蚓属于生态系统成分中的,与其功 2020-07-10 …
(2014•盐城三模)植物叶片气孔的开放程度对其光合作用强度有较大的影响.为了探究影响气孔开闭的因素 2020-11-12 …
试回答下列有关群落的问题:(1)群落是指,因此,研究生物群落要以研究为基础.(2)研究表明森林植物群 2020-12-22 …
某研究小组对氢氧化钠溶液是否变质进行了实验探究.请你一起参与探究,完成下面的实验报告并回答有关问题. 2021-01-22 …
某研究小组对氢氧化钠溶液是否变质进行了实验探究.请你一起参与探究,完成下面的实验报告并回答有关问题. 2021-01-22 …