早教吧作业答案频道 -->化学-->
电子级钴氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物,其工业制取流程如下:(1)滤渣A的成分除过量的Co的磷酸盐和Fe(OH)3外还有(填化学式).(2)加入CO3(
题目详情
电子级钴氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物,其工业制取流程如下: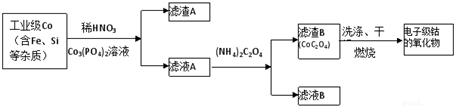
(1)滤渣A的成分除过量的Co的磷酸盐和Fe(OH)3外还有___(填化学式).
(2)加入CO3(PO4)2的目的是___.
(3)Co与稀硝酸反应生成 Co2+的离子方程式为:___.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图1,写出C点物质的化学式:___
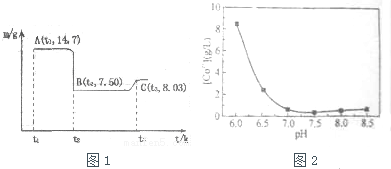
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1mol/L计算)
b.CoSO4与NH4HCO3反应时,母液中钴离子含量与溶液pH关系图如图2,
由钴渣酸浸液制备氧化钴的实验步骤依次为:
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH___,使___沉淀完全;
②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,___;
④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;
⑤400℃焙烧3h,得产品氧化钴.

(1)滤渣A的成分除过量的Co的磷酸盐和Fe(OH)3外还有___(填化学式).
(2)加入CO3(PO4)2的目的是___.
(3)Co与稀硝酸反应生成 Co2+的离子方程式为:___.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图1,写出C点物质的化学式:___

(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1mol/L计算)
| 开始沉淀的pH | 完全溶解的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为:
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pH___,使___沉淀完全;
②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,___;
④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;
⑤400℃焙烧3h,得产品氧化钴.
▼优质解答
答案和解析
工业级Co加入稀硝酸和磷酸钴,得到滤渣A含有CoSO4、Fe(OH)3、Si,滤液B含有Co2+,加入草酸铵生成CoC2O4,经洗涤、干燥、灼烧得到氧化钴,
(1)硅和硝酸不反应,滤渣A含有CoSO4、Fe(OH)3、Si,
故答案为:Si;
(2)铁离子以水解,加入Co3(PO4)2可调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀,
故答案为:调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀;
(3)Co和硝酸发生氧化还原反应,反应的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑,
故答案为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑;
(4)A为CoC2O4,n(CoC2O4)=
=0.1mol,m(Co)=0.1mol×59g/mol=5.9g,C点氧化物的质量为8.03g,则n(O)=
=1.33,则化学式为Co3O4,
故答案为:Co3O4;
(5)由表中数据可知,应先加入氢氧化钠除去Fe3+、Al3+,可调节pH5.0~7.2之间,然后过滤,在滤液中加入一定浓度的碳铵溶液,控制pH至7.0左右,使Co2+沉淀完全,过滤,将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;最后加热400℃焙烧3h,得产品氧化钴,
故答案为:①pH(5.0,7.2),Fe3+、Al3+;③控制pH至7.0左右,使Co2+沉淀完全,过滤.
(1)硅和硝酸不反应,滤渣A含有CoSO4、Fe(OH)3、Si,
故答案为:Si;
(2)铁离子以水解,加入Co3(PO4)2可调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀,
故答案为:调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀;
(3)Co和硝酸发生氧化还原反应,反应的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑,
故答案为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑;
(4)A为CoC2O4,n(CoC2O4)=
| 14.7g |
| 147g/mol |
| 8.03g-5.9g |
| 16g/mol |
故答案为:Co3O4;
(5)由表中数据可知,应先加入氢氧化钠除去Fe3+、Al3+,可调节pH5.0~7.2之间,然后过滤,在滤液中加入一定浓度的碳铵溶液,控制pH至7.0左右,使Co2+沉淀完全,过滤,将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;最后加热400℃焙烧3h,得产品氧化钴,
故答案为:①pH(5.0,7.2),Fe3+、Al3+;③控制pH至7.0左右,使Co2+沉淀完全,过滤.
看了电子级钴氧化物用于半导体工业和...的网友还看了以下:
除去粗盐中可溶性的氯化钙、氯化镁、硫酸钠等杂质,1.除去硫酸钠应加入的试剂是什么?化学方程式是什么 2020-05-14 …
数学题,分数乘除法!能简算的要简算,一个小时内回复还加分!1.7/9除以11/5+5/11*2/9 2020-06-03 …
去除和除以意思相同还是和除意思相同?急用,比如:2与2的和去除3,结果多少?算式是(2+2)*3还 2020-06-10 …
一个数,除以3还余2,除以4也余2,这个数最小是多少? 2020-06-14 …
关于函数求导Y=(X/1000)^1/2为什么我做出来是1/2*(X/1000)^(-1/2)而答 2020-07-13 …
淘气计算一道除法题时,把被除数126看错成162,算出来的商比正确答案多9,余数还是2,除数是多少 2020-07-18 …
淘气计算一道除法题时,把被除数126错看成162,算出来的商比正确结婚多9,余道还有2.除数是多了 2020-07-18 …
计算一道除法题时,把被除数126错看成162,算出来的商比正确结果多9,余数还是2.除数是多少?正 2020-07-18 …
我城市污水原水水质TP3mg/L要达到一级A标及0.5mg/L用氧化沟达不到我后续加什么深度处理或 2020-07-29 …
例如分数“6/2/3”应该怎么计算?是6先除以2,得数再除以3,还是6除以2/3?换句话说,直接约 2020-07-31 …