早教吧作业答案频道 -->化学-->
砷(As)是第四周期第VA族元素,用化学用语回答问题:(1)砷的最高价氧化物对应的水化物化学式是,气态氢化物的稳定性ASH3(填写“大于”或“小于”)NH3.(2)砷在自然界中主
题目详情
砷(As)是第四周期第V A族元素,用化学用语回答问题:
(1)砷的最高价氧化物对应的水化物化学式是___,气态氢化物的稳定性ASH3___(填写“大于”或“小于”)NH3.
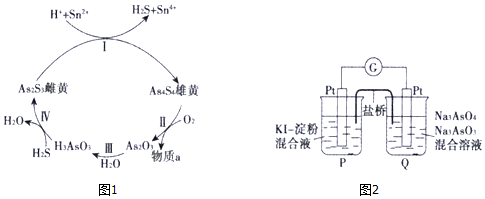
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.雄黄和雌黄的转换关系如图1所示:
①气体物质a是___(填化学式).
②第I步反应的离子方程式是___.
(3)Na2HAsO3溶液呈碱性,原因是___(用离子方程式表示),该溶液中c(H2AsO3-)___ c(AsO33-)(填“>”、“<”或“=”).
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O⇌AsO33-+I2+2OH-.当P池中溶液由无色变蓝色时,正极上的电极反应式为___;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是___.
(1)砷的最高价氧化物对应的水化物化学式是___,气态氢化物的稳定性ASH3___(填写“大于”或“小于”)NH3.
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.雄黄和雌黄的转换关系如图1所示:
①气体物质a是___(填化学式).
②第I步反应的离子方程式是___.

(3)Na2HAsO3溶液呈碱性,原因是___(用离子方程式表示),该溶液中c(H2AsO3-)___ c(AsO33-)(填“>”、“<”或“=”).
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O⇌AsO33-+I2+2OH-.当P池中溶液由无色变蓝色时,正极上的电极反应式为___;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是___.
▼优质解答
答案和解析
(1)As元素的最高正价为+5价,最高价氧化物对应的水化物化学式与磷酸相似,则砷的最高价氧化物对应的水化物化学式是H3AsO4;同主族从上到下,氢化物的稳定性减弱,则气态氢化物的稳定性AsH3小于NH3;
故答案为:H3AsO4;小于;
(2)①雄黄在空气中加热时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为:As4S4+7O2
2As2O3+4SO2,另一种氧化物为二氧化硫;
故答案为:SO2;
②依据转化关系分析可知,雌黄(As2S3)酸性溶液中和Sn2+离子发生氧化还原反应生成As4S4、H2S、Sn4+,结合电荷守恒、原子守恒配平书写离子方程式为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+,
故答案为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+;
(3)Na2HAsO3溶液呈碱性,是因为HAsO32-在溶液中发生水解反应,其水解反应的离子方程式为HAsO32-+H2O⇌H2AsO3-+OH-;Na2HAsO3溶液呈碱性,说HAsO32-的水解程度大于电离程度,所以该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:HAsO32-+H2O⇌H2AsO3-+OH-;>;
(4)电池总反应为AsO43-+2I-+H2O⇌AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池生成I2,发生氧化反应,是负极,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,则正极的电极方程式为AsO43-+2e-+H2O=AsO33-+2OH-;加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,P为正极,P池中I2得电子还原为I-,电极方程式为:I2+2e-=2I-;
故答案为:AsO43-+2e-+H2O=AsO33-+2OH-; I2+2e-=2I-.
故答案为:H3AsO4;小于;
(2)①雄黄在空气中加热时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为:As4S4+7O2
| ||
故答案为:SO2;
②依据转化关系分析可知,雌黄(As2S3)酸性溶液中和Sn2+离子发生氧化还原反应生成As4S4、H2S、Sn4+,结合电荷守恒、原子守恒配平书写离子方程式为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+,
故答案为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+;
(3)Na2HAsO3溶液呈碱性,是因为HAsO32-在溶液中发生水解反应,其水解反应的离子方程式为HAsO32-+H2O⇌H2AsO3-+OH-;Na2HAsO3溶液呈碱性,说HAsO32-的水解程度大于电离程度,所以该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:HAsO32-+H2O⇌H2AsO3-+OH-;>;
(4)电池总反应为AsO43-+2I-+H2O⇌AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池生成I2,发生氧化反应,是负极,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,则正极的电极方程式为AsO43-+2e-+H2O=AsO33-+2OH-;加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,P为正极,P池中I2得电子还原为I-,电极方程式为:I2+2e-=2I-;
故答案为:AsO43-+2e-+H2O=AsO33-+2OH-; I2+2e-=2I-.
看了砷(As)是第四周期第VA族元...的网友还看了以下:
语文B+数学A英语A+化学A物理A思想品德B+历史A地理A生物B+总分A可以上百高吗 2020-04-09 …
、现代社会中,人们把( )称为构成世界的三大要素.A.物质、能量、知识 B.信息、物质、能量 C. 2020-05-16 …
短周期元素A的原子,其最外层与最内层的电子数之和等于次外层电子数,A的元素符号是(),A元素与地壳 2020-05-20 …
ATM协议中哪一层实现将其他网络中接收的数据重新格式化________?A.物理B.ATMC.应用适 2020-05-23 …
X和Z是由A、B、C三种元素(A、B、C均为1~18号元素)形成的两种化合物.已知元素A在两种化合 2020-06-05 …
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,B元素所形 2020-06-12 …
元素A与钠形成的化合物的化学式为NaA,元素B与氯形成的氯化合物的化学式为BCly.则A、B两元素 2020-07-26 …
元素A与钠元素形成的化合物的化学式为NamA,元素B的氯化物的化学式为BCln,则A、B两元素组成 2020-07-29 …
元素A与钠形成的化合物的化学式为NaxA,元素B的氯化物化学式为BCly,则A、B两元素组成化合物 2020-07-29 …
求质量变化率.A物质的质量为1.6g,B物质的质量为1.3g,将二者放入某介质中4天温度为150℃ 2020-08-03 …