早教吧作业答案频道 -->化学-->
砷(As)广泛分布于自然界,其原子结构示意图是.(1)砷位于元素周期表中族,其气态氢化物的稳定性比NH3(填“强”或“弱”).(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定
题目详情
砷(As)广泛分布于自然界,其原子结构示意图是 .
.
(1)砷位于元素周期表中___族,其气态氢化物的稳定性比NH3___(填“强”或“弱”).
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差.根据下左图写出As2O5分解为As2O3的热化学方程式:___.
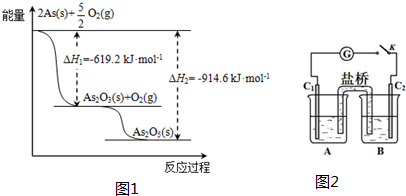
(3)砷酸盐可发生如下反应:AsO43-+2I-+2H+⇌AsO33-+I2+H2O.图2装置中,C1、C2是石墨电极. A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是___.
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样mg溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液.As2O5与NaOH溶液反应的离子方程式是___.
②上述混合液用0.02500mol•L-1的I2溶液滴定,用___做指示剂,滴定至___,停止滴定,记录数据.重复滴定2次,平均消耗I2溶液20.00mL.则试样中As2O5的质量分数是___.
 .
.(1)砷位于元素周期表中___族,其气态氢化物的稳定性比NH3___(填“强”或“弱”).
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差.根据下左图写出As2O5分解为As2O3的热化学方程式:___.

(3)砷酸盐可发生如下反应:AsO43-+2I-+2H+⇌AsO33-+I2+H2O.图2装置中,C1、C2是石墨电极. A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是___.
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样mg溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液.As2O5与NaOH溶液反应的离子方程式是___.
②上述混合液用0.02500mol•L-1的I2溶液滴定,用___做指示剂,滴定至___,停止滴定,记录数据.重复滴定2次,平均消耗I2溶液20.00mL.则试样中As2O5的质量分数是___.
▼优质解答
答案和解析
(1)最外层有5个电子,则As位于第ⅤA族,由同主族位置和元素周期律可知,非金属性N>As,则As的气态氢化物的稳定性比NH3弱,
故答案为:ⅤA;弱;
(2)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(3)B中滴加浓盐酸时发生AsO43-+2I-+2H+⇌AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO33-+H2O,
故答案为:AsO42-+2H++2e-=AsO33-+H2O;
(4)①因为As2O5为碱性氧化物,与NaOH溶液反应生成盐和水,所以离子方程式为:As2O5+6OH-═2AsO43-+3H2O,
故答案为:As2O5+6OH-═2AsO43-+3H2O;
②用I2溶液滴定可以用淀粉溶液作指示剂,当溶液由蓝色变为无色时说明达到滴定终点;
上述混合液用0.02500mol•L-1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33-+I2+H2O═AsO43-+2I-+2H+,As2O5+6OH-═2AsO43-+3H2O,
As2O5 ~2AsO43-~2I2
1 2
n 0.02500mol•L-1×20.00×10-3L
则n=2.5×10-4mol,
所以m(As2O5)=2.5×10-4mol×230g/mol=0.0575 g,
所以质量分数为
;
故答案为:淀粉;溶液由蓝色变为无色;
.
故答案为:ⅤA;弱;
(2)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(3)B中滴加浓盐酸时发生AsO43-+2I-+2H+⇌AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO33-+H2O,
故答案为:AsO42-+2H++2e-=AsO33-+H2O;
(4)①因为As2O5为碱性氧化物,与NaOH溶液反应生成盐和水,所以离子方程式为:As2O5+6OH-═2AsO43-+3H2O,
故答案为:As2O5+6OH-═2AsO43-+3H2O;
②用I2溶液滴定可以用淀粉溶液作指示剂,当溶液由蓝色变为无色时说明达到滴定终点;
上述混合液用0.02500mol•L-1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33-+I2+H2O═AsO43-+2I-+2H+,As2O5+6OH-═2AsO43-+3H2O,
As2O5 ~2AsO43-~2I2
1 2
n 0.02500mol•L-1×20.00×10-3L
则n=2.5×10-4mol,
所以m(As2O5)=2.5×10-4mol×230g/mol=0.0575 g,
所以质量分数为
| 0.0575 |
| m |
故答案为:淀粉;溶液由蓝色变为无色;
| 0.0575 |
| m |
看了砷(As)广泛分布于自然界,其...的网友还看了以下:
下列有关电子排布图的表述正确的是()A.可表示单核10电子粒子基态时电子排布B.此图错误,违背了泡 2020-05-14 …
物质的结构决定性质,性质反映其结构特点.(1)氮族元素包括N、P、As、Sb和Bi五种元素.①基态 2020-05-14 …
下图是N、O、F三种元素基态原子电子排布的轨道表示式。试回答下列问题(1)请认真分析去发现,N、O 2020-05-14 …
氢原子从定态n=3跃迁到n=2,再跃迁到n=1定态,则后一次跃迁辐射出的光子比前一次更易发生和光电 2020-06-26 …
一定量的理想气体从状态M可以经历过程1或者过程2到达状态N,其p-V图象如图所示.在过程1中,气体 2020-07-01 …
如图所示,一定质量的理想气体,由平衡状态M变化到平衡状态N,在这个过程中,气体必然()A.对外界做 2020-07-05 …
(2011•石家庄一模)激光制冷原理可以根据如图所示的能级图简单说明:激光射入介质中,引起介质中离子 2020-11-12 …
已知一次函数y=(m-3)x-n+4的图象与y轴的交点在x轴下方,且y随x的增大而增大,试确定m、n 2020-11-27 …
磁极M、N及周围的磁感线分布如图所示,下列说法正确的是()A.M、N一定都是S极B.M、N一定都是N 2020-12-25 …
[物理选修3-5模块](1)激光制冷原理可以根据如图所示的能级图简单说明,激光射入介质中,引起介质中 2021-01-05 …