早教吧作业答案频道 -->化学-->
氮、磷、砷为同主族元素,回答下列问题:(1)基态As原子的核外电子排布式为.(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是(用元素符号表示
题目详情
氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为___.
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是___ (用元素符号表示)
(3)As4O6的分子结构如图1所示,其中As原子的杂化方式为___,1mol As406含有σ键的物质的量为___.
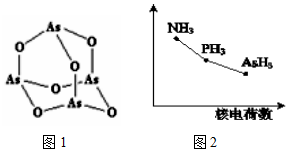
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是___.
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是___
(6)NH4+中的H-N-H的键角比 NH3中的H-N-H的键角___(填”大”或”小”),原因是___
___.
(1)基态As原子的核外电子排布式为___.
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是___ (用元素符号表示)
(3)As4O6的分子结构如图1所示,其中As原子的杂化方式为___,1mol As406含有σ键的物质的量为___.

(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是___.
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是___
(6)NH4+中的H-N-H的键角比 NH3中的H-N-H的键角___(填”大”或”小”),原因是___
___.
▼优质解答
答案和解析
(1)根据基态电子排布规律,As原子的基态电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,N原子半径比As和Ga 都小,电负性较大,故这3种元素的电负性由大至小的顺序是N>As>Ga,
故答案为:N>As>Ga;
(3)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化;1个As406分子中含有σ键数目为12个,故1mol As406含有σ键的物质的量为12mol,
故答案为:sp3;12mol;
(4)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,故A正确;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高,故B错误;
C.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能随原子序数的增大而减小,故C正确;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故D错误;
故答案为:AC;
(5)N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低,
故答案为:NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键;
(6)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H-N-H的键角比NH3中H-N-H的键角大,
故答案为:大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力.
故答案为:1s22s22p63s23p63d104s24p3;
(2)同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,N原子半径比As和Ga 都小,电负性较大,故这3种元素的电负性由大至小的顺序是N>As>Ga,
故答案为:N>As>Ga;
(3)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化;1个As406分子中含有σ键数目为12个,故1mol As406含有σ键的物质的量为12mol,
故答案为:sp3;12mol;
(4)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,故A正确;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高,故B错误;
C.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能随原子序数的增大而减小,故C正确;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故D错误;
故答案为:AC;
(5)N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低,
故答案为:NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键;
(6)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H-N-H的键角比NH3中H-N-H的键角大,
故答案为:大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力.
看了氮、磷、砷为同主族元素,回答下...的网友还看了以下:
某种产品是由A种原料和B种原料混合而成的,其中A种原料每千克50元,B种料每千克40元,由于市场的供 2020-03-30 …
打火机给人们生活带来方便.普通打火机一般由以下几部分组成:①压电陶瓷(产生电火花)②塑料机身③通风 2020-05-14 …
ATM的逻辑信遭由以下哪一个来标识?A.虚路径标识符B.虚信道标识符C.虚路径标识符和虚信道标识符D 2020-05-24 …
法律知识题甲乙签订一批服装的加工合同,由乙负责为甲加工服装200套,面料由甲提供,双方还约定了面料 2020-06-26 …
材料规格要用什么符号表示手里有一张采购单,棒料的材料规格是Φ22,可是板材的材料规格前面标识的符合看 2020-11-23 …
请问哪里可以查到如下俄罗斯材料和符号标准(如答案正确,100分奖励)1,МН95-5GOST492- 2020-12-10 …
下列广告语中,你认为符合科学道理的是()A.含碘食盐可防治甲状腺肿大B.含氟牙膏可预防龋齿,适用于所 2021-01-01 …
下列广告语中,你认为符合科学道理的是()A.“超纯水”、“超纯蒸馏水”绝对卫生,对人体有益B.含铁麦 2021-01-01 …
以下广告语中,符合科学道理的是()A.“超纯净水”绝对卫生,对人有益B.含碘食盐可以防治甲状腺肿大C 2021-01-01 …
以下广告语中,符合科学道理的是[]A.“超纯净水”绝对卫生,对人有益B.含碘食盐可以防治甲状腺肿大C 2021-01-01 …