早教吧作业答案频道 -->化学-->
AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.(1)As基态原子的电子占据了个能层,最高能级的电子排布式为.和As位于同一周期,且未成对
题目详情
AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.
(1)As基态原子的电子占据了___个能层,最高能级的电子排布式为___.和As位于同一周期,且未成对电子数也相同的元素还有___种.
(2)元素周期表中,与P紧邻的4种元素中电负性最大的是___(填元素符号).Si、P、S三种元素的第一电离能由大到小的顺序是___.
(3)NH3、PH3、AsH3三者的沸点由高到低的顺序是___,原因是___.
(4)白磷是由P4分子形成的分子晶体,P4分子呈正四面体结构,P原子位于正四面体的四个顶点,则P原子的杂化方式为___.白磷易溶于CS2,难溶于水,原因是___.
(5)采用GaxIn1-xAs(镓铟砷)等材料,可提高太阳能电池的效率.GaxIn1-xAs立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4个原子,则该晶胞中含有___砷原子.
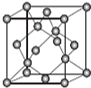
(6)AIN晶体的晶胞结构与金刚石相似(如图),设晶胞的边长为a cm,NA表示阿伏加德罗常数,则该晶体的密度为___g•cm-3.

(1)As基态原子的电子占据了___个能层,最高能级的电子排布式为___.和As位于同一周期,且未成对电子数也相同的元素还有___种.
(2)元素周期表中,与P紧邻的4种元素中电负性最大的是___(填元素符号).Si、P、S三种元素的第一电离能由大到小的顺序是___.
(3)NH3、PH3、AsH3三者的沸点由高到低的顺序是___,原因是___.
(4)白磷是由P4分子形成的分子晶体,P4分子呈正四面体结构,P原子位于正四面体的四个顶点,则P原子的杂化方式为___.白磷易溶于CS2,难溶于水,原因是___.
(5)采用GaxIn1-xAs(镓铟砷)等材料,可提高太阳能电池的效率.GaxIn1-xAs立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4个原子,则该晶胞中含有___砷原子.
(6)AIN晶体的晶胞结构与金刚石相似(如图),设晶胞的边长为a cm,NA表示阿伏加德罗常数,则该晶体的密度为___g•cm-3.
▼优质解答
答案和解析
(1)基态As原子核外电子排布式为1s22s22p63s23p63d104s24p3,含有4个能层,最高能级的电子排布式为4p3,和砷位于同一周期,且未成对电子数也相同的元素,它们的外围电子排布式为:3d34s2、3d74s2,分别为钒、钴两种,
故答案为:4;4p3;2;
(2)在元素周期表中,同周期中从左向右,元素的非金属性增强,电负性增强,同主族元素从上向下,元素的非金属性减弱,电负性减弱,在元素周期表中,与 P紧邻的4种元素中电负性最大的是N.
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,Si、P、S元素处于同一周期且原子序数逐渐增大,P处于第VA族,所以第一电离能P>S>Si,
故答案为:N;P>S>Si;
(3)NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物分子间作用力大,沸点高,故沸点:NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3;NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物分子间作用力大,沸点高;
(4)P4分子为正四面体构型,P4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,P原子采取sp3杂化.
相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于 CS2,难溶于水,
故答案为:sp3;P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于 CS2,难溶于水;
(5)GaxIn(1-x)As立方体形晶胞中每一个顶点和面心都有一个原子,晶胞内部有4个原子,晶胞含有总数为4+8×
+6×
=8,由化学式可知晶胞中As数目占原子总数的
,即晶胞中As原子数目为8×
=4,
故答案为:4;
(6)AIN晶胞中Al原子数目为8×
+6×
=4,N原子数目为4,故晶胞质量m=
,体积V=a3,密度ρ=
=
.
故答案为:
.
故答案为:4;4p3;2;
(2)在元素周期表中,同周期中从左向右,元素的非金属性增强,电负性增强,同主族元素从上向下,元素的非金属性减弱,电负性减弱,在元素周期表中,与 P紧邻的4种元素中电负性最大的是N.
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,Si、P、S元素处于同一周期且原子序数逐渐增大,P处于第VA族,所以第一电离能P>S>Si,
故答案为:N;P>S>Si;
(3)NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物分子间作用力大,沸点高,故沸点:NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3;NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物分子间作用力大,沸点高;
(4)P4分子为正四面体构型,P4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,P原子采取sp3杂化.
相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于 CS2,难溶于水,
故答案为:sp3;P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于 CS2,难溶于水;
(5)GaxIn(1-x)As立方体形晶胞中每一个顶点和面心都有一个原子,晶胞内部有4个原子,晶胞含有总数为4+8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:4;
(6)AIN晶胞中Al原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4(27+14) |
| NA |
| m |
| V |
| 164 |
| a3NA |
故答案为:
| 164 |
| a3NA |
看了AIN是重要的半导体材料,Ga...的网友还看了以下:
matlab:对多项式p=x4+2x3-5x+6和s=x2+2x+31.对多项式p=x4+2x3- 2020-05-17 …
●文法G=(VT,VN,P,S)的类型由G中的 (32) 决定。若G0=({a,b},{S,X,Y} 2020-05-25 …
对σ键的认识不正确的是()A.s-sσ键与s-pσ键的对称性相同B.σ键不属于共价键,是另一种化学 2020-08-01 …
对σ键的认识不正确的是()A.s-sσ键与s-pσ键的对称性相同B.σ键不属于共价键,是另一种化学 2020-08-01 …
对δ键的认识不正确的是()A.δ键是“头碰头”形成的共价键,是一种特殊的化学键不是每个共价化合物都 2020-08-01 …
对δ键的认识不正确的是()A.S-Sδ键与S-Pδ键的对称性相同B.δ键不属于共价键,是另一种化学 2020-08-01 …
对δ键的认识不正确的是()A.δ键不属于共价键,是另一种化学键B.s-sδ键与s-pδ键的对称性相 2020-08-01 …
对δ键的认识不正确的是A.δ键不属于共价键,是另一种化学键B.S-Sδ键与S-Pδ键的对称性相同C 2020-08-01 …
对δ键的认识不正确的是()A.δ键不属于共价键,是另一种化学键B.s-sδ键与s-pδ键的对称性相 2020-08-01 …
下列对σ键的认识不正确的是A.ssσ键与spσ键的对称性相同B.烯烃分子中的碳碳双键的键能是碳 2020-08-01 …