早教吧作业答案频道 -->化学-->
砷(As)是第四周期第VA族元素,用化学用语回答问题.(1)与砷同族的原子半径最小的元素形成单质的电子式为,其气态氢化物的稳定性比AsH3(填“强”或“弱”)(2)砷在自然界
题目详情
砷(As)是第四周期第VA族元素,用化学用语回答问题.
(1)与砷同族的原子半径最小的元素形成单质的电子式为___,其气态氢化物的稳定性比AsH3___(填“强”或“弱”)
(2)砷在自然界中主要以硫化物形式(如雄黄AS4S4、雌黄As2S3等)存在.
①工业上以雄黄为原料制备砷的过程是先在空气中煅烧使其转化为砒霜(As2O3),然后用焦炭还原,写出锻烧时发生反应的化学方程式为___.
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为___.
(3)已知H3AsO3是两性偏酸性的化合物,NaHAsO3溶液呈碱性,原因是___(用离子方程式表示),该溶液中c(H2AsO3-)___c (AsO33-)(填“>”、“<”或“=”).
(4 )己知砷酸(H3AsO4)是三元酸,有较强的氧化性.
①常温下砷酸的K1=6×10-3、K2=1×10-7,则0.6mol•L-1的砷酸溶液中c(H+)约为___ mol•L-1.
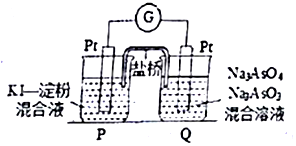
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O⇌AsO43-+I2+2OH-.当P池中溶液由无色变成蓝色时,正极上的电极反应式为___.当电流计指针归中后向Q池中加入一定量的NaOH,则电子由___(填“P”或“Q”)池中的流出.

(1)与砷同族的原子半径最小的元素形成单质的电子式为___,其气态氢化物的稳定性比AsH3___(填“强”或“弱”)
(2)砷在自然界中主要以硫化物形式(如雄黄AS4S4、雌黄As2S3等)存在.
①工业上以雄黄为原料制备砷的过程是先在空气中煅烧使其转化为砒霜(As2O3),然后用焦炭还原,写出锻烧时发生反应的化学方程式为___.
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为___.
(3)已知H3AsO3是两性偏酸性的化合物,NaHAsO3溶液呈碱性,原因是___(用离子方程式表示),该溶液中c(H2AsO3-)___c (AsO33-)(填“>”、“<”或“=”).
(4 )己知砷酸(H3AsO4)是三元酸,有较强的氧化性.
①常温下砷酸的K1=6×10-3、K2=1×10-7,则0.6mol•L-1的砷酸溶液中c(H+)约为___ mol•L-1.
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O⇌AsO43-+I2+2OH-.当P池中溶液由无色变成蓝色时,正极上的电极反应式为___.当电流计指针归中后向Q池中加入一定量的NaOH,则电子由___(填“P”或“Q”)池中的流出.
▼优质解答
答案和解析
(1)与砷同族的原子半径最小的元素为氮元素,形成的单质为氮气,电子式为 ,氮原子间形成三对共用电子对,同主族氢化物稳定性减弱,气态氢化物NH3的稳定性比AsH3 强,
,氮原子间形成三对共用电子对,同主族氢化物稳定性减弱,气态氢化物NH3的稳定性比AsH3 强,
故答案为: ;强;
;强;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫,反应的化学方程式为:As4S4+7O2
2As2O3+4SO2,
故答案为:As4S4+7O2
2As2O3+4SO2;
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,As的化合价从+3价升高到+5价,S的化合价从-2价升高到0价,N的化合价从+5价降低到+4价,则反应中还原剂与氧化剂物质的量之比为1:10;
故答案为:1:10;
(3)NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解,其水解方程式为:;HAsO32-在溶液中电离程度小于水解程度,以水解为主,水解生成H2AsO3-,则该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:HAsO32-+H2O⇌H2AsO3-+OH-;>;
(4)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=
,以第一步电离为主,则c(H+)≈
=
=0.06mol/L;
故答案为:0.06;
②P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出;
故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
 ,氮原子间形成三对共用电子对,同主族氢化物稳定性减弱,气态氢化物NH3的稳定性比AsH3 强,
,氮原子间形成三对共用电子对,同主族氢化物稳定性减弱,气态氢化物NH3的稳定性比AsH3 强,故答案为:
 ;强;
;强;(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫,反应的化学方程式为:As4S4+7O2
| ||
故答案为:As4S4+7O2
| ||
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,As的化合价从+3价升高到+5价,S的化合价从-2价升高到0价,N的化合价从+5价降低到+4价,则反应中还原剂与氧化剂物质的量之比为1:10;
故答案为:1:10;
(3)NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解,其水解方程式为:;HAsO32-在溶液中电离程度小于水解程度,以水解为主,水解生成H2AsO3-,则该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:HAsO32-+H2O⇌H2AsO3-+OH-;>;
(4)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=
| c(H2AsO4-)c(H+) |
| c(H3AsO4) |
| K1×c(H3AsO4) |
| 6×10-3×0.6 |
故答案为:0.06;
②P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出;
故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
看了砷(As)是第四周期第VA族元...的网友还看了以下:
某气体X可能由氢气、一氧化碳、甲烷中的一种或几种组成,将X气体燃烧后生成的气体通过A、B两个洗气瓶 2020-05-16 …
物理化学中的气相液化成液相为什么组成不变~再汽化时就要根据拉布尔定律来求组成了?比如A和B形成理想 2020-06-23 …
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C, 2020-11-02 …
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D能生成C,A露置在 2020-11-02 …
3种气体通入A.B瓶某气体X可能是氢气、一氧化碳、甲烷,将X气体燃烧后生成的气体通入A、B两个洗气瓶 2020-11-03 …
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C, 2020-12-08 …
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C, 2020-12-08 …
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C, 2020-12-08 …
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间最终变为 2020-12-08 …
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C, 2020-12-08 …