早教吧作业答案频道 -->化学-->
氮族元素(Nitrogengroup)是元素周期表ⅤA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种.(1)氮族元素的外围电子排布式的通式为;基态磷原子中,
题目详情
氮族元素(Nitrogen group)是元素周期表ⅤA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种.
(1)氮族元素的外围电子排布式的通式为___;基态磷原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___.
(2)PH3分子的VSEPR模型为___,键角NH3___H2O(填“>”、“<”或“=”).
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为___.
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是___.
②NH3易与Cu2+反应,而NF3却不能,其原因是___.
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则磷原子的配位数为___;已知磷化硼的晶胞边长a=478pm,计算晶体中硼原子和磷原子的核间距(dB-P)=___pm(保留三位有效数字)
(1)氮族元素的外围电子排布式的通式为___;基态磷原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___.
(2)PH3分子的VSEPR模型为___,键角NH3___H2O(填“>”、“<”或“=”).
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为___.
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是___.
②NH3易与Cu2+反应,而NF3却不能,其原因是___.
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则磷原子的配位数为___;已知磷化硼的晶胞边长a=478pm,计算晶体中硼原子和磷原子的核间距(dB-P)=___pm(保留三位有效数字)
▼优质解答
答案和解析
(1)氮族元素的外围电子为其最外层上s、p能级电子,则氮族元素外围电子排布式为ns2np3;
基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道,所以有9个轨道,
故答案为:ns2np3;M;9;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型为四面体形,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,氨气分子中只含一个孤电子对、水分子中含有两个孤电子对,所以键角,故答案为:四面体形;>;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为
=2,根据价层电子对互斥理论判断原子杂化方式为sp,
故答案为:sp;
(4)①NH3存在氢键,而NF3只存在分子间作用力,两种作用力前者较强,物质的沸点较高,
故答案为:NH3能形成氢键,NF3只有范德华力;
②F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,
故答案为:F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示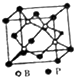 ,该晶胞中B原子为4个、P原子个数=8×
,该晶胞中B原子为4个、P原子个数=8×
+6×
=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的
=
×
a=
×
×478pm=207pm,
故答案为:207.
基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道,所以有9个轨道,
故答案为:ns2np3;M;9;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型为四面体形,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,氨气分子中只含一个孤电子对、水分子中含有两个孤电子对,所以键角,故答案为:四面体形;>;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为
| 5-1 |
| 2 |
故答案为:sp;
(4)①NH3存在氢键,而NF3只存在分子间作用力,两种作用力前者较强,物质的沸点较高,
故答案为:NH3能形成氢键,NF3只有范德华力;
②F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,
故答案为:F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示
 ,该晶胞中B原子为4个、P原子个数=8×
,该晶胞中B原子为4个、P原子个数=8×| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
| 3 |
| 1 |
| 4 |
| 3 |
故答案为:207.
看了氮族元素(Nitrogengr...的网友还看了以下:
一道用朗格郎日乘数法解的问题已知多元函数U(x1,x2),其限制条件为p1*x1+p2*x2=MM 2020-05-15 …
验证(x^2-2xy+y^2)dx-(x^2-2xy-y^2)dy是某个二元函数u=u(x,y)的 2020-05-17 …
设关系R和S都是二元关系,那么与元组表达式{t|u)(|v)(R(u)∧S(v)∧u[1]=v[1] 2020-05-26 …
初中化学周期元素表的背诵口诀我要的是最新的那21个元素,并非“氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩 2020-06-09 …
若在右半平面x>0上的向量A(x,y)={2xy(x^4+y^2)^λ,-x^2(x^4+y^2) 2020-06-27 …
阅读《液氮表演》,回答下列各题.液氮表演液态氮为无色、无味,不易燃烧,不会爆炸,沸点是-196℃的 2020-07-28 …
∫dx/xlnxlnlnx(1)∫dx/[xlnxln(lnx)]=∫d(lnx)/[lnxln( 2020-08-01 …
某同学用图1中的器材来探究一电学元件的U-I关系.采用电流表外接法,要求加在电学元件上的电压从零开始 2021-01-22 …
U、V、W、Y、Z是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如下表;U元素与氧元 2021-02-01 …
U、V、W、Y是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如表;U元素与氧元素能形 2021-02-01 …