早教吧作业答案频道 -->化学-->
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:(1)写出步骤Ⅰ中发生
题目详情
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:
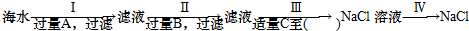
(1)写出步骤Ⅰ中发生反应的离子方程式是___,___.
(2)步骤Ⅱ中试剂B为___,加入过量B的目的是___.
(3)步骤Ⅲ中试剂C为___,加入适量C至___,其目的是___.
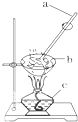
(4)步骤Ⅳ的实验操作为___,试根据图示回答:
①按顺序写出图中编号仪器的名称:___;
②仪器a的作用是___,其目的是___;
③当仪器b中出现___时即可停止加热.
某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:
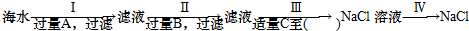

(1)写出步骤Ⅰ中发生反应的离子方程式是___,___.
(2)步骤Ⅱ中试剂B为___,加入过量B的目的是___.
(3)步骤Ⅲ中试剂C为___,加入适量C至___,其目的是___.
(4)步骤Ⅳ的实验操作为___,试根据图示回答:
①按顺序写出图中编号仪器的名称:___;
②仪器a的作用是___,其目的是___;
③当仪器b中出现___时即可停止加热.
▼优质解答
答案和解析
海水中其中70%为氯化钠,另外还含有氯化镁、硫酸镁等,要得到较纯净的NaCl,应该除去海水中的Mg2+、SO42-,Mg2+用NaOH溶液除去,生成Mg(OH)2沉淀,SO42-用BaCl2溶液除去,生成BaSO4沉淀,因为加入的氯化钡溶液过量,用Na2CO3除去BaCl2,用适量稀盐酸除去过量的碳酸钠,过滤后得到NaCl溶液,最后蒸发浓缩、冷却结晶得到NaCl晶体;
所以该流程图中A为NaOH、BaCl2溶液,B为Na2CO3溶液、C为稀盐酸,
(1)步骤Ⅰ中除去镁离子和硫酸根离子,分别生成氢氧化镁、硫酸钡沉淀,发生反应的离子方程式是Mg2++2OH-=Mg(OH)2↓、Ba2++SO42-=BaSO4↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Ba2++SO42-=BaSO4↓;
(2)步骤Ⅱ中试剂目的是除去过量的氯化钡,B为Na2CO3,
故答案为:Na2CO3;使Ba2+全部转化为碳酸钡沉淀除去;
(3)步骤Ⅲ中试剂目的是除去过量的碳酸钠和过量的氢氧根离子且不能引进新的杂质,C为稀盐酸,加入适量的C至无气体产生,
故答案为:稀盐酸;无气体产生;除去过量的CO32-和OH-;
(4)步骤Ⅳ的实验操作为蒸发,故答案为:蒸发;
①a为玻璃棒、b是蒸发皿、c是酒精灯,故答案为:a为玻璃棒、b是蒸发皿、c是酒精灯;
②仪器a是玻璃棒,起搅拌作用,防止局部温度过高而溅出液体,从而易产生安全事故,
故答案为:搅拌;防止溶液局部温度过高而溅出液体;
③当仪器b中出现大量固体时即可停止加热,利用余热将溶液蒸干,
故答案为:大量固体.
所以该流程图中A为NaOH、BaCl2溶液,B为Na2CO3溶液、C为稀盐酸,
(1)步骤Ⅰ中除去镁离子和硫酸根离子,分别生成氢氧化镁、硫酸钡沉淀,发生反应的离子方程式是Mg2++2OH-=Mg(OH)2↓、Ba2++SO42-=BaSO4↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Ba2++SO42-=BaSO4↓;
(2)步骤Ⅱ中试剂目的是除去过量的氯化钡,B为Na2CO3,
故答案为:Na2CO3;使Ba2+全部转化为碳酸钡沉淀除去;
(3)步骤Ⅲ中试剂目的是除去过量的碳酸钠和过量的氢氧根离子且不能引进新的杂质,C为稀盐酸,加入适量的C至无气体产生,
故答案为:稀盐酸;无气体产生;除去过量的CO32-和OH-;
(4)步骤Ⅳ的实验操作为蒸发,故答案为:蒸发;
①a为玻璃棒、b是蒸发皿、c是酒精灯,故答案为:a为玻璃棒、b是蒸发皿、c是酒精灯;
②仪器a是玻璃棒,起搅拌作用,防止局部温度过高而溅出液体,从而易产生安全事故,
故答案为:搅拌;防止溶液局部温度过高而溅出液体;
③当仪器b中出现大量固体时即可停止加热,利用余热将溶液蒸干,
故答案为:大量固体.
看了海水是盐的“故乡”,海水中含有...的网友还看了以下:
五年级下学期第10课意思梁国杨氏之子九岁,甚聪惠.孔君平诣其父,父不在,乃呼儿出.为设果,果有杨梅 2020-04-25 …
看补充的鸟.梁国\杨氏子\九岁,甚聪慧.孔君平\诣\其父,父\不在,乃\呼儿出.为\设果,果\有杨 2020-05-14 …
阅读理解!《杨氏之子》梁国杨氏子九岁,甚聪惠.孔君平指其父,父不在,乃呼儿出.为设果,果有杨梅.孔 2020-05-14 …
梁国杨氏子九岁,甚聪惠.孔君平诣其父,父不在,乃呼儿出.为设果,果有杨梅.孔指以示儿曰:“此是君家 2020-05-14 …
《扬氏之子》梁国/杨氏子/九岁,甚聪惠.孔君平/诣/其父,父不在,乃/呼儿出.为设果,果/有扬梅. 2020-05-22 …
用/画出这篇短文的停顿梁国杨氏子九岁,甚聪惠.孔君平诣其父,父不在,乃呼儿出.为设果,果有杨梅.孔 2020-06-12 …
杨氏之子阅读理解梁国杨氏子九岁,甚聪惠.孔君平诣其父,父不在,乃呼儿出.为设果,果有杨梅.孔指以示 2020-07-15 …
梁国杨氏之子九岁,甚聪慧.孔君平谐其父,父不在,呼儿出.为设果,果有杨梅.孔指以示儿出曰:“此是君家 2020-11-13 …
英语翻译梁国杨氏子九岁,甚聪慧.孔君平(言旨)其父,父不在,乃呼儿出.为设果,果有杨梅.孔指以示曰: 2020-11-13 …
《杨氏之子》梁国杨氏子九岁,甚聪惠.孔君平诣其父,父不在,乃呼儿出.为设果,果有杨梅.孔指以示儿曰: 2020-11-13 …