早教吧作业答案频道 -->化学-->
我国市售加碘食盐中含有碘酸钾.已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.工业生产碘酸钾的流程如下:请回答下列问题:(1)已知反应室
题目详情
我国市售加碘食盐中含有碘酸钾.已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.工业生产碘酸钾的流程如下:
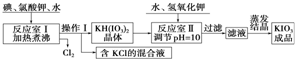
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:___.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②___
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
由上表数据分析可知,操作Ⅰ的名称为___、___.
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是___.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为___(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示___.
②根据乙同学的实验结果推测,甲同学的实验结果会___(填“偏大”,“偏小”或“无影响”).

请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:___.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②___
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100g水(25℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100g水(80℃) | 37.1 | 12.4 | 16.2 |
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是___.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为___(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
②根据乙同学的实验结果推测,甲同学的实验结果会___(填“偏大”,“偏小”或“无影响”).
▼优质解答
答案和解析
(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应除去反应生成的氯气,有利于反应正反应方向进行,
故答案为:除去反应生成的氯气,有利于反应正反应方向进行;
(3)表数据分析可知KH(IO3)2在常温下溶解度小,操作Ⅰ是得到KH(IO3)2晶体,操作的名称为:冷却结晶,过滤得到晶体,
故答案为:冷却结晶,过滤;
(4)KH(IO3)2在碱性条件下可以转化成KHIO3,所以步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3,由于KIO3的溶解度受温度的影响较大且分解温度较高,所以采取蒸发结晶的方法,
故答案为:使KH(IO3)2转化为KIO3;
(5)设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O3 2-=2I-+S4 O62-②,将方程式②×3+①得
IO3+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0mol/L×0.012L
x=0.004mol,碘酸钾的质量=0.004mol×214g/mol=0.856g,所以碘酸钾的质量分数=
×100%=85.6%,
故答案为:85.6%;
(6)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O;
且酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,
故答案为:4I-+4H++O2=2I2+2H2O;偏大;
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应除去反应生成的氯气,有利于反应正反应方向进行,
故答案为:除去反应生成的氯气,有利于反应正反应方向进行;
(3)表数据分析可知KH(IO3)2在常温下溶解度小,操作Ⅰ是得到KH(IO3)2晶体,操作的名称为:冷却结晶,过滤得到晶体,
故答案为:冷却结晶,过滤;
(4)KH(IO3)2在碱性条件下可以转化成KHIO3,所以步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3,由于KIO3的溶解度受温度的影响较大且分解温度较高,所以采取蒸发结晶的方法,
故答案为:使KH(IO3)2转化为KIO3;
(5)设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O3 2-=2I-+S4 O62-②,将方程式②×3+①得
IO3+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0mol/L×0.012L
x=0.004mol,碘酸钾的质量=0.004mol×214g/mol=0.856g,所以碘酸钾的质量分数=
| 0.856g |
| 1g |
故答案为:85.6%;
(6)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O;
且酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,
故答案为:4I-+4H++O2=2I2+2H2O;偏大;
看了我国市售加碘食盐中含有碘酸钾....的网友还看了以下:
用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是()A、实验使用的主要仪器是分液漏斗B、碘 2020-05-13 …
下列实验操作错误的是()A.称量易潮解、腐蚀性固体药品时,将药品盛放在小烧杯里称量B.用酒精萃取碘 2020-05-17 …
用四氯化碳萃取碘水中的碘,下列说法中不正确的是( )A. 实验中使用的主要仪器是分液漏斗B. 碘 2020-05-17 …
三峡工程是举世瞩目的跨实际工程,现在有一艘轮船从水位是130M的下游进入闸室,已知闸室中原来的水位 2020-06-30 …
(2012•南宁)衣服上沾有碘很难洗净,碘在下列四种不同溶剂中的溶解性如下表所示:溶质碘溶剂水酒精 2020-06-30 …
衣服上沾有碘很难洗净,碘在下列四种不同溶剂中的溶解性如表所示:溶质碘溶剂水酒精汽油苯(有毒)溶解性 2020-06-30 …
衣服上沾有碘很难洗净,碘在下列四种不同溶剂中的溶解性如右表所示。由表中提供的信息判断,能最快洗净衣 2020-07-10 …
如何计算承台顶相对标高和底板相对标高?地下室已知底板绝对标高为0.3,承台顶已知绝对标高为-1.2 2020-07-21 …
从地面通往地下室的台阶共有12级,已知地下室距地面2.4米,则地面向下第一级台阶是高度为?规定地面的 2020-11-21 …
下列有关实验的说法中错误的是()①用酒精从碘水中萃取碘②用加热方法从碘和沙子的混合物中分离出碘③实验 2021-02-01 …