早教吧作业答案频道 -->化学-->
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO
题目详情
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO•Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO•Cr2O3+24NaOH+7KClO3
12Na2CrO4+3Fe2O3+7KCl+12H2O
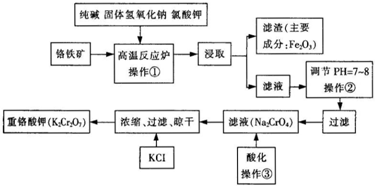
请根据以上工艺流程回答下列问题:
(1)在操作①中,高温反应炉内有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质Si02、Al203与纯碱反应转变为可溶性盐,写出氧化铝与纯碱反应的化学方程式___.
(2)操作②的目的是___o
(3)操作③中,酸化时加入硫酸可将Na2CrO4溶液转化成重铬酸钠(Na2Cr2O7)溶液,该反应的离子方程式为___.欲分离反应后溶液中的Na2SO4和Na2Cr2O7,可釆用的方法是___(填实验操作名称).
(4)称取该工艺所得重铬酸钾样品2.5000g配成250mL溶液,取出25.00mL置于捵量瓶中,加入10mL2mol/LH2SO4和足量KI溶液(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O
═2I-+S4O
).
①判断达到滴定终点的依据是:___;
②实验中共用去Na2S2O3标准溶液40.00mL,则该样品中重铬酸钾的纯度为___%(设整个过程中其它杂质不参与反应,保留两位小数)
6FeO•Cr2O3+24NaOH+7KClO3
| ||

请根据以上工艺流程回答下列问题:
(1)在操作①中,高温反应炉内有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质Si02、Al203与纯碱反应转变为可溶性盐,写出氧化铝与纯碱反应的化学方程式___.
(2)操作②的目的是___o
(3)操作③中,酸化时加入硫酸可将Na2CrO4溶液转化成重铬酸钠(Na2Cr2O7)溶液,该反应的离子方程式为___.欲分离反应后溶液中的Na2SO4和Na2Cr2O7,可釆用的方法是___(填实验操作名称).
(4)称取该工艺所得重铬酸钾样品2.5000g配成250mL溶液,取出25.00mL置于捵量瓶中,加入10mL2mol/LH2SO4和足量KI溶液(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O
| 2- 3 |
| 2- 6 |
①判断达到滴定终点的依据是:___;
②实验中共用去Na2S2O3标准溶液40.00mL,则该样品中重铬酸钾的纯度为___%(设整个过程中其它杂质不参与反应,保留两位小数)
▼优质解答
答案和解析
流程分析可知,铬铁矿(主要成份为FeO•Cr2O3)为原料粉碎后再反应器中加入纯碱、固体氢氧化钠、氯酸钾浸取过滤得到滤液调节溶液PH过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾,
(1)高温条件下,氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳,反应方程式为:Al2O3+Na2CO3
2NaAlO2+CO2↑,
故答案为:Al2O3+Na2CO3
2NaAlO2+CO2↑;
(2)②调节后溶液的pH比原来降低,是由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O⇌HSiO3-+OH-、HSiO3-+H2O⇌H2SiO3+OH-、AlO2-+2H2O⇌Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成H2SiO3、Al(OH)3沉淀而除去,
故答案为:降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成H2SiO3、Al(OH)3沉淀而除去;
(3)CrO42-和酸反应生成Cr2O72-和水,转化方程式为:2CrO42-+2H+⇌Cr2O72-+H2O,分离反应后溶液中的Na2SO4和Na2Cr2O7,可釆用结晶的方法;
故答案为:2CrO42-+2H+⇌Cr2O72-+H2O;结晶;
(5)①达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化,
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在Cr2O72-~6S2O32-,
1 6
n 0.1200mol/L×0.040L
n=0.0008mol
250ml溶液中含有Cr2O72-物质的量为0.0008mol×
=0.008mol;
所得产品中重铬酸钾纯度=
×100%=94.08%,
故答案为:94.08.
(1)高温条件下,氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳,反应方程式为:Al2O3+Na2CO3
| ||
故答案为:Al2O3+Na2CO3
| ||
(2)②调节后溶液的pH比原来降低,是由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O⇌HSiO3-+OH-、HSiO3-+H2O⇌H2SiO3+OH-、AlO2-+2H2O⇌Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成H2SiO3、Al(OH)3沉淀而除去,
故答案为:降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成H2SiO3、Al(OH)3沉淀而除去;
(3)CrO42-和酸反应生成Cr2O72-和水,转化方程式为:2CrO42-+2H+⇌Cr2O72-+H2O,分离反应后溶液中的Na2SO4和Na2Cr2O7,可釆用结晶的方法;
故答案为:2CrO42-+2H+⇌Cr2O72-+H2O;结晶;
(5)①达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化,
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在Cr2O72-~6S2O32-,
1 6
n 0.1200mol/L×0.040L
n=0.0008mol
250ml溶液中含有Cr2O72-物质的量为0.0008mol×
| 250 |
| 25 |
所得产品中重铬酸钾纯度=
| 0.008mol×294g/mol |
| 2.500g |
故答案为:94.08.
看了重铬酸钾(K2Cr2O7)是工...的网友还看了以下:
某一部件由三个电子元件按如图方式连接而成,元件1或元件2正常工作,且元件3正常工作,则部件正常工作 2020-04-06 …
急死.一盏有pz220-40字样的灯泡,不考虑温度对电阻的影响,1正常工作的电压是2正常工作时电功 2020-05-20 …
某一部件由三个电子元件按下图方式连接而成,元件1或元件2正常工作,且元件3正常工作,则部件正常工作 2020-06-10 …
以HbS代表正常孩子致病基因,HbA代表其正常的等位基因.一对表现型正常的夫妇,生了一个患镰刀型细 2020-07-04 …
徐、王、陈、赵四位师傅分别是工厂的木工、车工、电工和钳工,他们都是象棋迷.(1)电工只和车工下棋; 2020-07-08 …
乙醇是一种重要的化工原料.(1)工业制乙醇的化学方程式是.(2)常温常压下,23g乙醇完全燃烧生成二 2020-11-04 …
英语翻译1.常回家看看可能成为一种法律规定2.使常回家看看法律化的原因(年轻人忙于工作和学习,不经常 2020-11-14 …
刘、王、孙、陈四人是某厂的工段长、统计员、车工、电工.已知:(1)工段长只找车工下棋,而且总是输给车 2020-11-25 …
如图所示,是一款集自动清扫技术和人工智能设计于一体的地面清扫机器人,其规格为“6V36W”.求:(1 2020-12-02 …
我国是一个历史悠久的文明古国.在古代没有冰箱及其他一些现代所采用的食品防腐方法时,我国古代劳动人民就 2021-01-05 …