已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是()A.反应过程中的
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )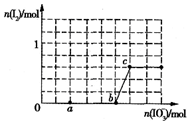
A. 反应过程中的氧化产物均为Na2HSO4
B. a点时剩余NaHSO3的物质的量为1.0 mol
C. 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO43-+I-+3H2O
D. 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol
B.a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=
| 0.4mol |
| 1 |
C.0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,故C错误;
D.根据反应IO3-+3HSO3-═I-+3SO42-+3H+,3mol NaHSO3的溶液消耗KIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为n,则根据反应IO3-+6H++5I-=3H2O+3I2,消耗的KIO3的物质的量为
| n |
| 3 |
| 5n |
| 3 |
| 5n |
| 3 |
| 5n |
| 3 |
| 3 |
| 10 |
| n |
| 3 |
| 1 |
| 10 |
故选D.
初三化学电离请详细解答,谢谢!(38:21:34)为什么有些物质,如同盐,溶解在水中,或如同糖熔化 2020-04-27 …
帮我回答几个地质问题呗41、简述什么是褶皱构造,褶皱的基本类型及其识别特征,并简明说明褶皱构造的工 2020-07-04 …
我要怎么选?地质的朋友帮帮我!我是学水文与工程地质的,现在在一家水利设计院工作,我们单位都是学水工的 2020-11-10 …
地质工程与工程地质的区别? 2020-11-21 …
求具体证明过程o(x的n次方)×o(x的m次方)=o(x的m+n次方)x趋向于零 2020-12-15 …
用同一热源加热某种物质,使其从固态变成液态,直至沸腾.整个过程物质的温度与时间关系图象如图所示,下列 2020-12-18 …
用同一热源加热某种物质,使其从固态变成液态,直至沸腾.整个过程物质的温度与时间关系图象如图所示,下列 2020-12-18 …
(2013•蒙城县一模)用同一热源加热某种物质,使其从固态变成液态,直至沸腾.整个过程物质的温度与时 2020-12-18 …
用同一热源加热某种物质,使其从固态变成液态,直至沸腾。整个过程物质的温度与时间关系图像如图所示,下列 2021-01-12 …
用同一热源加热某种物质,使其从固态变成液态,直至沸腾.整个过程物质的温度与时间关系图像如图所示,下列 2021-01-12 …