早教吧作业答案频道 -->化学-->
第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.(1)下列叙述正确的是.(填字母)A.CH2O与水分子间能形成氢键B.CH2O和CO2分子中的中心原子均采用sp2杂化C.C6H6分子中含有6
题目详情
第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.
(1)下列叙述正确的是___.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
Mn原子价电子排布式为___,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是___.
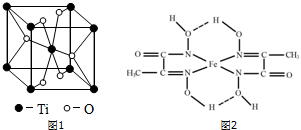
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于___区.Ti的一种氧化物X,其晶胞结构如图1所示,则X的化学式为___.
(4)某铁的化合物结构简式如图2所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为___ (用元素符号表示)
②在图2中用“→”标出亚铁离子的配位键.
(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为___,这几个O2-构成的空间构型为___.已知Ni2+与O2-的核间距为anm,NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为___ g/cm3.
(1)下列叙述正确的是___.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于___区.Ti的一种氧化物X,其晶胞结构如图1所示,则X的化学式为___.

(4)某铁的化合物结构简式如图2所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为___ (用元素符号表示)
②在图2中用“→”标出亚铁离子的配位键.
(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为___,这几个O2-构成的空间构型为___.已知Ni2+与O2-的核间距为anm,NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为___ g/cm3.
▼优质解答
答案和解析
(1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键,故A正确;
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对,HCHO分子中C原子采用sp2杂化,二氧化碳分子中C原子为sp杂化,故B错误;
C.C6H6分子中含有12个σ键和1个大π键,故C错误;
D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,
故答案为:AD;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2,其价电子排布式为3d54s2,
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(3)Ti处于第四周期第ⅣB族,属于d区元素,每个晶胞中含有钛原子数为8×
+1=2,氧原子数为4×
+2=4,故化学式为TiO2,
故答案为:d;TiO2;
(4)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大,故电负性大小为O>N>C>H,
故答案为:O>N>C>H;
②形成8电子稳定结构时,N原子形成3个共价键,微粒中N原子形成4个键,其中1个是N原子与亚铁离子形成的配位键,标出配位键为: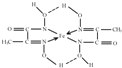 ,
,
故答案为: ;
;
(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为6,以晶胞体心的Ni2+研究,与之最邻近的6个O2-位于面心,这几个O2-构成的空间构型为正八面体;
Ni2+与O2-的核间距为a nm,则晶胞棱长为2a nm,晶胞中Ni2+、O2-离子数目均为4,晶胞的质量为6×
,则晶体密度为4×
÷(2a×10-7cm)3=
g/cm3,
故答案为:6;正八面体;
.
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对,HCHO分子中C原子采用sp2杂化,二氧化碳分子中C原子为sp杂化,故B错误;
C.C6H6分子中含有12个σ键和1个大π键,故C错误;
D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,
故答案为:AD;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2,其价电子排布式为3d54s2,
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(3)Ti处于第四周期第ⅣB族,属于d区元素,每个晶胞中含有钛原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:d;TiO2;
(4)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大,故电负性大小为O>N>C>H,
故答案为:O>N>C>H;
②形成8电子稳定结构时,N原子形成3个共价键,微粒中N原子形成4个键,其中1个是N原子与亚铁离子形成的配位键,标出配位键为:
 ,
,故答案为:
 ;
;(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为6,以晶胞体心的Ni2+研究,与之最邻近的6个O2-位于面心,这几个O2-构成的空间构型为正八面体;
Ni2+与O2-的核间距为a nm,则晶胞棱长为2a nm,晶胞中Ni2+、O2-离子数目均为4,晶胞的质量为6×
| Mg/mol |
| NAmol-1 |
| Mg/mol |
| NAmol-1 |
| M×1021 |
| 2a3NA |
故答案为:6;正八面体;
| M×1021 |
| 2a3NA |
看了第四周期过渡元素Mn、Fe、T...的网友还看了以下:
下列对基因组文库的叙述不正确的是()A.含有某种生物的全部基因B.基因中含有启动子和内含子C.文库 2020-04-08 …
对基因组文库的描述,不正确的是()A.含有某种生物的全部基因B.基因中含有启动子和内含子C.文库的 2020-04-08 …
对基因组文库的描述,不正确的是()含有某种生物的全部基因B.基因中含有启动子和内含子C.文库的基因 2020-04-08 …
对基因组文库的描述,不正确的是()A.含有某种生物的全部基因B.基因中含有启动子和内含子C.文库的 2020-04-08 …
下列属于cDNA文库特征的是()A.基因中有启动作用的DNA片段B.基因中含有外显子和内含子C.某 2020-04-08 …
已知:物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应;物质C的相对分子质量为104.A 2020-06-12 …
下列模式图表示几种细胞器,有关说法不正确的是()A、C、E均含有少量的DNAB、植物细胞一定都含有 2020-06-30 …
A为只含有C、H、O三种元素的芳香烃衍生物,各物质间的相互转化关系如图.已知:ROH+HX△RX+ 2020-07-09 …
基因组文库和cDNA文库区别相比,基因组文库所含基因A.种类较多B.无内含子C.无启动子D.在不同物 2020-12-02 …
某化合物在隔绝空气的条件下分解生成了CO2和H2O,这说明该化合物中()A.一定含有CO2H2OB. 2020-12-24 …