早教吧作业答案频道 -->化学-->
A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.回答下
题目详情
A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.
回答下列问题:
(1)B元素在元素周期表中的位置是___;A离子的结构示意图为___.
(2)用电子式表示化合物BG的形成过程:___.
(3)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为___.
(4)①B2A2中含有___键和___键.
②该物质与水反应的化学反应方程式为___.
(5)下列说法正确的是___(填字母序号).
a.B、D、E原子半径依次减小
b.六种元素的最高正化合价均等于其原子的最外层电子数
c.E的单质是人类将太阳能转换为电能的常用材料
d.元素气态氢化物的稳定性:F>A>G
(6)比较F和G最高价氧化物对应水化物酸性的强弱:F___G(填“>”、“=”或“<”),用原子结构解释原因:同周期元素电子层数相同,从左至右,___,得电子能力逐渐增强,元素非金属性逐渐增强.
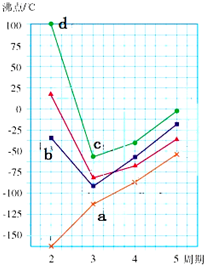
(7)NH3、H2O和HF的沸点反常,原因是它们分子间存在氢键.ⅣA~ⅧA族的部分非金属气态氢化物的沸点如下图所示,E的氢化物的化学式为___,该氢化物位于如图中的___点(填字母序号).
回答下列问题:

(1)B元素在元素周期表中的位置是___;A离子的结构示意图为___.
(2)用电子式表示化合物BG的形成过程:___.
(3)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为___.
(4)①B2A2中含有___键和___键.
②该物质与水反应的化学反应方程式为___.
(5)下列说法正确的是___(填字母序号).
a.B、D、E原子半径依次减小
b.六种元素的最高正化合价均等于其原子的最外层电子数
c.E的单质是人类将太阳能转换为电能的常用材料
d.元素气态氢化物的稳定性:F>A>G
(6)比较F和G最高价氧化物对应水化物酸性的强弱:F___G(填“>”、“=”或“<”),用原子结构解释原因:同周期元素电子层数相同,从左至右,___,得电子能力逐渐增强,元素非金属性逐渐增强.
(7)NH3、H2O和HF的沸点反常,原因是它们分子间存在氢键.ⅣA~ⅧA族的部分非金属气态氢化物的沸点如下图所示,E的氢化物的化学式为___,该氢化物位于如图中的___点(填字母序号).
▼优质解答
答案和解析
A、B、D、E、F、G是原子序数依次增大的六种短周期元素,B、D、G的最高价氧化物对应水化物两两之间都能反应,则它们应属于酸、碱、两性氢氧化物,A和B能形成B2A和B2A2两种化合物,则可知,B为钠元素,A为氧元素,D应为铝元素,D、F、G原子最外层电子数之和等于15,且原子序数G大于F,G的最高价氧化物对应水化物应为强酸,所以G为氯元素,F为磷元素,则E为硅元素,
(1)B为钠元素,位于在元素周期表中第3周期 第IA族;A氧元素,氧离子的结构示意图为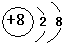 ,故答案为:第3周期 第IA族;
,故答案为:第3周期 第IA族;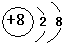 ;
;
(2)化合物BG为氯化钠,用电子式表示的形成过程为 ,
,
故答案为: ;
;
(3)铝可以与氢氧化钠溶液反应,其离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)①B2A2为过氧化钠含有,两个氧原子之间为非极性共价键,钠离子与过氧离子之间为离子键,故答案为:离子;(非极性)共价;
②过氧化钠与水反应的化学反应方程式为 2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(5)a.同周期元素,随着原子序数的增加,原子半径逐渐减小,所以B、D、E原子半径依次减小,故a正确;
b.氧元素最外层有6个电子,但氧元素的最高正价小于6,故b错误;
c.硅是人类将太阳能转换为电能的常用材料,故c正确;
d.非金属性越强,元素气态氢化物越稳定,磷元素的非金属性小于氯,所以磷化氢的稳定性小于氯化氢,故d错误;
故选ac;
(6)磷酸的酸性比高氯酸弱,用原子结构解释原因:同周期元素电子层数相同,从左至右,核电荷数逐渐增多,原子半径逐渐减小,得电子能力逐渐增强,元素非金属性逐渐增强,故答案为:<;核电荷数逐渐增多,原子半径逐渐减小;
(7)E的氢化物的化学式为SiH4,硅是第ⅣA族元素,该族元素的氢化物不能形成氢键,所以熔沸点的变化没有反常的,随着原子序数的增加而增加,所以SiH4位于如图中的a点,故答案为:SiH4; a.
(1)B为钠元素,位于在元素周期表中第3周期 第IA族;A氧元素,氧离子的结构示意图为
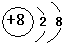 ,故答案为:第3周期 第IA族;
,故答案为:第3周期 第IA族;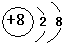 ;
;(2)化合物BG为氯化钠,用电子式表示的形成过程为
 ,
,故答案为:
 ;
;(3)铝可以与氢氧化钠溶液反应,其离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)①B2A2为过氧化钠含有,两个氧原子之间为非极性共价键,钠离子与过氧离子之间为离子键,故答案为:离子;(非极性)共价;
②过氧化钠与水反应的化学反应方程式为 2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(5)a.同周期元素,随着原子序数的增加,原子半径逐渐减小,所以B、D、E原子半径依次减小,故a正确;
b.氧元素最外层有6个电子,但氧元素的最高正价小于6,故b错误;
c.硅是人类将太阳能转换为电能的常用材料,故c正确;
d.非金属性越强,元素气态氢化物越稳定,磷元素的非金属性小于氯,所以磷化氢的稳定性小于氯化氢,故d错误;
故选ac;
(6)磷酸的酸性比高氯酸弱,用原子结构解释原因:同周期元素电子层数相同,从左至右,核电荷数逐渐增多,原子半径逐渐减小,得电子能力逐渐增强,元素非金属性逐渐增强,故答案为:<;核电荷数逐渐增多,原子半径逐渐减小;
(7)E的氢化物的化学式为SiH4,硅是第ⅣA族元素,该族元素的氢化物不能形成氢键,所以熔沸点的变化没有反常的,随着原子序数的增加而增加,所以SiH4位于如图中的a点,故答案为:SiH4; a.
看了A、B、D、E、F、G是原子序...的网友还看了以下:
下列说法错误的是A.P4O6中的磷原子采用SP3方式杂化B三氧化二磷、五氧化二磷这两个名称都只表示 2020-04-11 …
在CH3COCH3中中间碳原子和两边碳原子成键所采用的杂化方式分别是()A.sp2杂化、sp3杂化 2020-05-13 …
在CH3COCH3中中间碳原子和两边碳原子成键所采用的杂化方式分别是()A.sp2杂化、sp3杂化 2020-05-13 …
主题数据库的概念和设计思想源于()。A.企业系统规划法B.原型化法C.结构化生命周期化D.战略数据规 2020-05-24 …
数据库的概念和设计思想源于()。A.企业系统规划法B.原型化法C.战略数据规划法D.结构化生命周期法 2020-05-24 …
结构化分析与设计是信息系统开发时常用的方法。按其生命周期特征,它应属于()。A.V模型B.原型化模型 2020-05-26 …
下列关于分子、原子的说法错误的是()A.保持铁的化学性质的最小微粒是铁原子B.在化学反应中,分子可 2020-07-16 …
对物质组成结构的认识错误的是()A.构成物质的粒子之间一定存在间隙B.氧化物中一定含有氧元素C.原子 2020-12-21 …
下列说法中错误的是()A.一切原子的原子核都是由质子和中子构成的B.原子在化学变化中不再发生改变C. 2020-12-21 …
分子与原子的主要区别是()A.分子大,原子小B.在化学变化中,分子能分,原子不能分C.分子之间有间隙 2020-12-21 …