硫-碘循环分解水制氢主要涉及下列反应:Ⅰ.SO2+2H2O+I2=H2SO4+2HIⅡ.2HIH2↑+I2Ⅲ.2H2SO4=2SO2+O2↑+2H2O(1)分析上述反应,下列判断
硫 - 碘循环分解水制氢主要涉及下列反应:
Ⅰ .SO 2 +2H 2 O+I 2 =H 2 SO 4 +2HI
Ⅱ .2HI  H 2 ↑ +I 2
H 2 ↑ +I 2
Ⅲ .2H 2 SO 4 =2SO 2 +O 2 ↑ +2H 2 O
(1) 分析上述反应,下列判断正确的是 。
a. 反应Ⅲ易在常温下进行
b. 反应Ⅰ中 SO 2 氧化性比 HI 强
c. 循环过程中需补充 H 2 O
d. 循环过程中产生 1 mol O 2 的同时产生 1 mol H 2
(2) 一定温度下,向 1 L 密闭容器中加入 1 mol HI(g) ,发生反应Ⅱ, H 2 的物质的量随时间的变化如图所示。
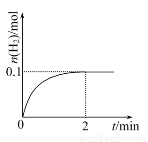
① 0 ~ 2 min 内的平均反应速率 v(HI)= 。
②相同温度下,若开始加入 HI(g) 的物质的量是原来的 2 倍,则 是原来的 2 倍。
a.HI 的平衡浓度
b. 达到平衡的时间
c. 平衡时 H 2 的体积分数
(3) 实验室用 Zn 和稀硫酸制取 H 2 ,若加入少量下列固体试剂中的 ,产生 H 2 的速率将增大。
a.NaNO 3 b.CuSO 4 c .Na 2 SO 4 d.NaHSO 3
(1)根据题意可知,因为是分解水制取H2的反应,所以应不断补充水,产生2 mol H2时,生成1 mol O2,c对、d错;硫酸常温不分解,a错;反应Ⅰ中SO2为还原剂,HI为还原产物,还原性SO2>HI,b错。(2)①2 min时H2的平衡浓度为0.1 mol·L-1,H2的平均反应速率为0.1 mol·L-1/2 min=0.05 mol·L-1·min-1,v(HI)=2v(H2)=0.05 mol·L-1·min-1×2=0.1 mol·L-1·min-1。②2HIH2+I2为反应前后气体体积不变的反应,在恒容容器中发生反应,HI的物质的量增加为原来的2倍,平衡不移动,但是反应速率加快,反应时间缩短,达到平衡时各组分浓度为原来的2倍,而体积分数不变。(3)根据反应Zn+2H+=Zn2++H2↑可知,增大反应速率,只要增大H+浓度即可,NaHSO3与H+反应,H+浓度减小,反应速率减小;Na2SO4对反应速率没影响;NaNO3与H+结合会生成HNO3,反应不产生H2;只有CuSO4合适,Zn+Cu2+=Cu+Zn2+,Zn与生成的Cu形成原电池,反应速率加快。
在“I”和“YOU”中添一个词,哪个能让你感动I love you:我爱你 I miss you: 2020-05-14 …
( 24 )通道是一种A ) I/O 设备 B ) I/O 控制器 C ) I/O 处理机 D )设 2020-05-23 …
通道是一种________。A.I/O设备B.I/O控制器C.I/O处理机D.设备控制器 2020-05-23 …
网络安全技术主要是研究:安全攻击、安全机制和安全服务,以下I.有损网络安全的操作II.用于检测、预防 2020-05-31 …
信息安全就是要保障电子信息的有效性,以下I.保密性II.完整性III.可用性IV.可控制哪些是电子信 2020-05-31 …
I'm和I区别我知道I是“我”,I'm是“我是”.可I'mlost(我迷路了)为什么要用I'm那中 2020-06-10 …
1.下列加点字注音有误的一项是()A.制裁(cái)恍若(huǎng)赃物(zāng)B.琉璃(l 2020-07-07 …
1.下列加点字注音有误的一项是()A.制裁(cái)恍若(huǎng)赃物(zāng)B.琉璃(l 2020-07-07 …
请教计算机组成原理问答题1.除了采用高速芯片外,分别指出存储器、运算器、控制器和I/O系统各自可采用 2020-11-03 …
为了减少运费,下列企业最需要接近市场的是()A.制糖厂B.造船厂C.瓶装饮料厂D.高级时装厂E.印刷 2020-11-13 …