早教吧作业答案频道 -->化学-->
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2
题目详情
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
回收处理该废旧电池可以得到多种化工原料,有关数据下图所示:溶解度/(g/100g水)
某化学课外小组设计了如下废旧电池综合利用工艺(不考虑废旧电池中实际存在的少量其他金属):
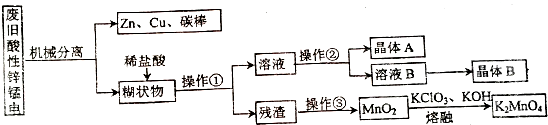
回答下列问题:
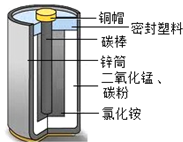
(1)该酸性锌锰干电池放电时的正极反应式为___;
(2)晶体A的化学式为___;
(3)操作③的名称为___;
(4)从MnO2获得K2MnO4的反应方程式为___;
(5)用废电池的锌皮制作ZnSO4•7H2O,需去除少量杂质铁,其方法是:
①加入足量的稀H2SO4和H2O2溶解.加入H2O2反应的离子方程式是___;
②加碱调节pH为___,使铁刚好完全沉淀,过滤.向滤液中继续加碱调节pH使锌刚好完全沉淀.过滤、洗涤.
③将沉淀溶于稀H2SO4,经过___(答操作名称)、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是___.
回收处理该废旧电池可以得到多种化工原料,有关数据下图所示:溶解度/(g/100g水)
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |

回答下列问题:

(1)该酸性锌锰干电池放电时的正极反应式为___;
(2)晶体A的化学式为___;
(3)操作③的名称为___;
(4)从MnO2获得K2MnO4的反应方程式为___;
(5)用废电池的锌皮制作ZnSO4•7H2O,需去除少量杂质铁,其方法是:
①加入足量的稀H2SO4和H2O2溶解.加入H2O2反应的离子方程式是___;
②加碱调节pH为___,使铁刚好完全沉淀,过滤.向滤液中继续加碱调节pH使锌刚好完全沉淀.过滤、洗涤.
③将沉淀溶于稀H2SO4,经过___(答操作名称)、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是___.
▼优质解答
答案和解析
(1)原电池的正极应是氧化剂发生还原反应,根据原电池的总反应Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH可知正极反应式为MnO2+e-+NH4+=MnOOH+NH3,
故答案为:MnO2+e-+NH4+=MnOOH+NH3;
(2)废电池经机械分离后,糊状物主要为MnO2、MnOOH、NH4Cl、碳粉、Zn(NH3)2Cl2等.加稀盐酸溶解得到氯化铵和氯化锌溶液,过滤得残渣主要为MnO2、MnOOH、碳粉,残渣在空气中灼烧碳被氧化成二氧化碳,MnOOH被氧化成二氧化锰,二氧化锰在碱性高温的条件下被氯酸钾氧化成锰酸钾,根据氯化铵和氯化锌的溶解度可知,混合溶液经浓缩后过滤可得晶体A为NH4Cl,再将滤液蒸发结晶可得晶体B为氯化锌,
故答案为:NH4Cl;
(3)根据(2)中的分析可知操作③的名称为在空气中灼烧,
故答案为:在空气中灼烧;
(4)根据流程可知,二氧化锰在碱性高温的条件下被氯酸钾氧化成锰酸钾,反应的化学方程式为3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O,
故答案为:3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O;
(5)锌皮含有少量杂质铁,溶于稀硫酸和双氧水,得硫酸锌和硫酸铁混合溶液,调节pH值使铁刚好完全沉淀,锌不沉淀,过滤除去铁,再调节pH值使锌生成氢氧化锌沉淀,将氢氧化锌溶于硫酸得硫酸锌溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O,
①加入H2O2氧化亚铁离子,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②根据Fe(OH)3的Ksp可知,铁离子沉淀完全时,溶液中c(OH-)=
=1×10-11 mol/L,所以溶液的pH值为3,使铁刚好完全沉淀,
故答案为:3;
③硫酸锌溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是降低晶体的溶解度,减少损失,
故答案为:蒸发浓缩、冷却结晶;降低晶体的溶解度,减少损失.
故答案为:MnO2+e-+NH4+=MnOOH+NH3;
(2)废电池经机械分离后,糊状物主要为MnO2、MnOOH、NH4Cl、碳粉、Zn(NH3)2Cl2等.加稀盐酸溶解得到氯化铵和氯化锌溶液,过滤得残渣主要为MnO2、MnOOH、碳粉,残渣在空气中灼烧碳被氧化成二氧化碳,MnOOH被氧化成二氧化锰,二氧化锰在碱性高温的条件下被氯酸钾氧化成锰酸钾,根据氯化铵和氯化锌的溶解度可知,混合溶液经浓缩后过滤可得晶体A为NH4Cl,再将滤液蒸发结晶可得晶体B为氯化锌,
故答案为:NH4Cl;
(3)根据(2)中的分析可知操作③的名称为在空气中灼烧,
故答案为:在空气中灼烧;
(4)根据流程可知,二氧化锰在碱性高温的条件下被氯酸钾氧化成锰酸钾,反应的化学方程式为3MnO2+KClO3+6KOH
| ||
故答案为:3MnO2+KClO3+6KOH
| ||
(5)锌皮含有少量杂质铁,溶于稀硫酸和双氧水,得硫酸锌和硫酸铁混合溶液,调节pH值使铁刚好完全沉淀,锌不沉淀,过滤除去铁,再调节pH值使锌生成氢氧化锌沉淀,将氢氧化锌溶于硫酸得硫酸锌溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O,
①加入H2O2氧化亚铁离子,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②根据Fe(OH)3的Ksp可知,铁离子沉淀完全时,溶液中c(OH-)=
| 3 |
| ||
故答案为:3;
③硫酸锌溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是降低晶体的溶解度,减少损失,
故答案为:蒸发浓缩、冷却结晶;降低晶体的溶解度,减少损失.
看了 酸性锌锰干电池是一种一次性电...的网友还看了以下:
下列有关原电池的说法不正确的是()A.锌锰干电池中锌电极是负极,工作时锌被还原B.锌与稀硫酸反应时 2020-05-13 …
【高一化学】原电池的反应问题》》》目前常用的银锌电池的总反映为Ag2O+Zn+H2O=放电=》/《 2020-05-14 …
铜锌原电池 硫酸锌 硫酸铜 一些基本的问题锌为什么会溶解? 不是不和硫酸锌反应吗?是锌片和铜 2020-05-15 …
1、可以利用氢气做燃料发射火箭,其反应的化学方程式是()2、纽扣电池是一种微型银锌电池,在电池内装 2020-06-05 …
如果原电池的电极材料为铁和锌,电解质溶液是FeCl3,那么Fe3+和Fe反应还是锌失电子,如果原电池 2020-10-31 …
关于锌片和铜片放在稀硫酸里做成原电池的一些问题将锌片和铜片连起来(通电)后锌片上还有气泡生成吗?什么 2020-11-01 …
纽扣电池是一种微型银锌电池,在电池内装有氧化银和锌等物质,当电池工作时,是锌与氧化银反应生成一种单质 2020-12-12 …
某化学兴趣小组对电化学问题进行了实验探究.Ⅰ.利用图1装置探究金属的防护措施,实验现象是锌电极不断溶 2020-12-14 …
某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解, 2020-12-24 …
铜锌原电池的装置如图所示,下列说法正确的是()A.锌电极上发生还原反应B.铜电极上发生氧化反应C.铜 2020-12-26 …