早教吧作业答案频道 -->化学-->
如图是氧化沉淀法生产复印用高档Fe3O4粉的部分工艺流程简图.(1)试剂X是(写化学式).(2)操作Y的名称为,该操作需要的玻璃仪器有烧杯、玻璃棒、等,玻璃棒在此操作中的主
题目详情
如图是氧化沉淀法生产复印用高档Fe3O4粉的部分工艺流程简图.
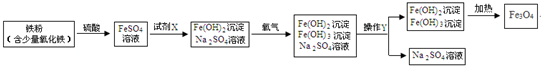
(1)试剂X是___(写化学式).
(2)操作Y的名称为___,该操作需要的玻璃仪器有烧杯、玻璃棒、___等,玻璃棒在此操作中的主要作用是___.
(3)硫酸与氧化铁的反应的化学方程式为___.
(4)往铁粉(含少量氧化铁)中加入硫酸,除铁、氧化铁与硫酸发生反应外,一定还发生其它反应.作出这种判断的依据是___.
(5)通入氧气时的化学方程式是:___(请补充完整)4Fe(OH)2+2+O2═4Fe(OH)3,由沉淀获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O,因此,通入氧气时,必须控制“一定量”,其目的是___.
(6)取该实验中FeSO4溶液100g,向其中滴加足量的NaOH溶液,测得Fe(OH)2沉淀的质量为4.05g,试计算:
①FeSO4溶液中溶质的质量分数是多少(精确到0.01%).
②最终得到产品四氧化三铁质量.(精确到0.01)

(1)试剂X是___(写化学式).
(2)操作Y的名称为___,该操作需要的玻璃仪器有烧杯、玻璃棒、___等,玻璃棒在此操作中的主要作用是___.
(3)硫酸与氧化铁的反应的化学方程式为___.
(4)往铁粉(含少量氧化铁)中加入硫酸,除铁、氧化铁与硫酸发生反应外,一定还发生其它反应.作出这种判断的依据是___.
(5)通入氧气时的化学方程式是:___(请补充完整)4Fe(OH)2+2+O2═4Fe(OH)3,由沉淀获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3
| ||
(6)取该实验中FeSO4溶液100g,向其中滴加足量的NaOH溶液,测得Fe(OH)2沉淀的质量为4.05g,试计算:
①FeSO4溶液中溶质的质量分数是多少(精确到0.01%).
②最终得到产品四氧化三铁质量.(精确到0.01)
▼优质解答
答案和解析
(1)FeSO4与试剂1生成了Fe(OH)2和Na2SO4,所以试剂1为氢氧化钠;故答案为:NaOH;
(2)将混合物中沉淀和溶液分开的操作是过滤,该操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,过滤时玻璃棒起引流的作用;故答案为:过滤;漏斗;引流;
(3)氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式为3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;故答案为:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(4)铁、氧化铁与硫酸发生反应生成硫酸亚铁和硫酸铁,但生成物中只有硫酸亚铁,可见在里面一定还发生了我们并不知道的其它反应.故答案为:生成物只有一种;
(5)根据氢氧化亚铁与氧气、水反应生成氢氧化铁,所以化学方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3.故填:4Fe(OH)2+2H2O+O2═4Fe(OH)3.
由沉淀获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O,因此,通入氧气时,必须控制“一定量”,其目的是防止氢氧化亚铁被完全氧化成氢氧化铁.故填:防止氢氧化亚铁被完全氧化成氢氧化铁.
(6)设硫酸亚铁质量为x,
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,
152 90
x 4.05g
=
x=6.84g,
FeSO4溶液中溶质的质量分数是:
×100%=6.84%,
设最终得到产品四氧化三铁质量为y,
由反应过程可知,硫酸亚铁中的铁元素完全转化到四氧化三铁中,
根据题意有:6.84g×
×100%=y×
×100%
=3.48g,
答:FeSO4溶液中溶质的质量分数是6.84%,最终得到产品四氧化三铁质量是3.48g.
(2)将混合物中沉淀和溶液分开的操作是过滤,该操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,过滤时玻璃棒起引流的作用;故答案为:过滤;漏斗;引流;
(3)氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式为3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;故答案为:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(4)铁、氧化铁与硫酸发生反应生成硫酸亚铁和硫酸铁,但生成物中只有硫酸亚铁,可见在里面一定还发生了我们并不知道的其它反应.故答案为:生成物只有一种;
(5)根据氢氧化亚铁与氧气、水反应生成氢氧化铁,所以化学方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3.故填:4Fe(OH)2+2H2O+O2═4Fe(OH)3.
由沉淀获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3
| ||
(6)设硫酸亚铁质量为x,
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,
152 90
x 4.05g
| 152 |
| 90 |
| x |
| 4.05g |
x=6.84g,
FeSO4溶液中溶质的质量分数是:
| 6.84g |
| 100g |
设最终得到产品四氧化三铁质量为y,
由反应过程可知,硫酸亚铁中的铁元素完全转化到四氧化三铁中,
根据题意有:6.84g×
| 56 |
| 152 |
| 56×3 |
| 232 |
=3.48g,
答:FeSO4溶液中溶质的质量分数是6.84%,最终得到产品四氧化三铁质量是3.48g.
看了 如图是氧化沉淀法生产复印用高...的网友还看了以下:
下列实验操作有误的是()A.在观察小鱼尾鳍内的血液流动现象时要用放大镜观察B.可用碘液检验食物中是 2020-07-01 …
下列有关实验现象的描述中,正确的是?A.将盐酸滴入氢氧化钠溶液中,有沉淀产生.B.将铁锈放入稀盐酸 2020-07-05 …
硫酸铜溶液中加入氨水生成沉淀然后再加入氨水直到沉淀刚好溶解然后再加入硫酸铜溶液后又有沉淀生成.为.. 2020-11-04 …
怎么知道有化学反应中沉淀出现好像HCl和AgNO3反应有白色沉淀出现硫酸和BaCo3反应也有沉淀产生 2020-11-16 …
钢化玻璃俗称普通玻璃的化身,是普通玻璃经一定物理方法处理后得到的.钢化玻璃一般不会发生自爆现象,但当 2020-11-20 …
下列实验不能达到预期目的是()序号实验操作实验目的A将充满NO2的密闭玻璃球浸泡在热水中研究温度对化 2020-12-04 …
如果反应物里有微溶物处于悬浊液或固态,而且生成物中有沉淀,那么生成的沉淀要不要打沉淀符号?参考书上写 2020-12-12 …
下列事实或现象与胶体性质无关的是()A.三氯化铁溶液中加入NaOH溶液出现红褐色沉淀B.煮沸的FeC 2020-12-27 …
某无色溶液好友下列五种离子中的几种:k+Ba2+Cl-CO32-SO42-取少量溶液加入bacl2溶 2021-01-01 …
下列叙述正确的是()A.SO2能使高锰酸钾溶液褪色,说明SO2有漂白性B.水玻璃中通CO2可得到胶状 2021-01-12 …