早教吧作业答案频道 -->化学-->
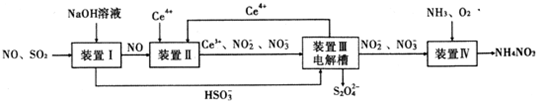
工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素).请回答下列问题.(1)装置Ⅱ中NO在酸性
题目详情
工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素).
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式___.
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
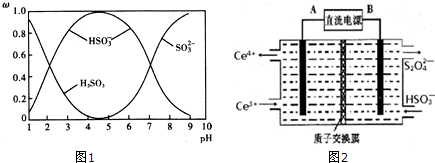
①下列说法正确的是___(填标号).
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时的溶液中c(OH-)=c(H+)+c(HSO4-)+c(H2SO4)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为___.
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在___(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是___.
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.
图中A为电源的___(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为___.
(4)已知进人装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为___ L.

请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式___.
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.

①下列说法正确的是___(填标号).
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时的溶液中c(OH-)=c(H+)+c(HSO4-)+c(H2SO4)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为___.
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在___(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是___.
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.
图中A为电源的___(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为___.
(4)已知进人装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为___ L.
▼优质解答
答案和解析
装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2++2H++2NH3=2NH4++2NO3-,
(1)装置Ⅱ中NO在酸性条件下NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(2)①A.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故A正确;
B.HSO3-⇌SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故B正确;
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;
D.溶液存在质子守恒,应为c(OH-)=c (H+)+c(HSO3-)+2c(H2SO3),故D错误;
故答案为:ABC;
②1L1.0mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1L×1.0mol/L=1.0mol,13.44L(标况下)SO2,n(SO2)=
=0.6mol,
设反应生成亚硫酸钠的物质的量为x,消耗二氧化硫的物质的量为y
2NaOH+SO2═Na2SO3+H2O
2 1 1
1.0mol y x
=
=
解得:x=0.5mol y=0.5mol根据上述计算可以知道,二氧化硫是过量的,剩余的二氧化硫的物质的量为:0.6mol-0.5mol=0.1mol
所以二氧化硫会和生成的亚硫酸钠继续反应,
设消耗亚硫酸钠的物质的量为a,生成亚硫酸氢钠的物质的量为b
Na2SO3+H2O+SO2═2NaHSO3
1 1 2
a 0.1mol b
=
=
解得:a=0.1mol b=0.2mol,
则溶液中n(SO32-)=0.5mol-0.1mol=0.4mol,n(HSO3-)=0.2mol,n(SO32-):n(HSO3-)=2:1,则反应的离子方程式为3SO2+5OH-=2SO32-+HSO3-+2H2O,
故答案为:3SO2+5OH-=2SO32-+HSO3-+2H2O;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液,酸性高锰酸钾溶液呈酸性,则可以盛放在酸式滴定管中;原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变;
故答案为:酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,连接电源正极,反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:正;2HSO3-+2H++2e-=S2O42-+2H2O;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒:
×4=1000×(5-3)×0.4mol,解得V=4480L,
故答案为:4480.
(1)装置Ⅱ中NO在酸性条件下NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(2)①A.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故A正确;
B.HSO3-⇌SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故B正确;
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;
D.溶液存在质子守恒,应为c(OH-)=c (H+)+c(HSO3-)+2c(H2SO3),故D错误;
故答案为:ABC;
②1L1.0mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1L×1.0mol/L=1.0mol,13.44L(标况下)SO2,n(SO2)=
| 13.44L |
| 22.4L/mol |
设反应生成亚硫酸钠的物质的量为x,消耗二氧化硫的物质的量为y
2NaOH+SO2═Na2SO3+H2O
2 1 1
1.0mol y x
| 2 |
| 1.0mol |
| 1 |
| y |
| 1 |
| x |
所以二氧化硫会和生成的亚硫酸钠继续反应,
设消耗亚硫酸钠的物质的量为a,生成亚硫酸氢钠的物质的量为b
Na2SO3+H2O+SO2═2NaHSO3
1 1 2
a 0.1mol b
| 1 |
| a |
| 2 |
| b |
| 1 |
| 0.3mol |
则溶液中n(SO32-)=0.5mol-0.1mol=0.4mol,n(HSO3-)=0.2mol,n(SO32-):n(HSO3-)=2:1,则反应的离子方程式为3SO2+5OH-=2SO32-+HSO3-+2H2O,
故答案为:3SO2+5OH-=2SO32-+HSO3-+2H2O;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液,酸性高锰酸钾溶液呈酸性,则可以盛放在酸式滴定管中;原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变;
故答案为:酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,连接电源正极,反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:正;2HSO3-+2H++2e-=S2O42-+2H2O;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒:
| VL |
| 22.4L/mol |
故答案为:4480.
看了 工业生产中产生的SO2、NO...的网友还看了以下:
对包含n个元素的散列表进行检索,平均检索长度为( )。A.O(log2n)B.O(n)C.O(n*l 2020-05-23 …
对包含n个元素的散列表进行检索,平均检索长度( )。A.为O(log2n)B.为O(n)C.为O(n 2020-05-23 …
对包含n个元素的散列表进行检索,平均检索长度________。A.为O(log2n)B.为O(n)C 2020-05-23 …
对包含n个元素的散列表进行检索,平均检索长度A.为O(10g2n)B.为O(n)C.为O(nlog2 2020-05-23 …
对包含n个元素的散列表进行检索,平均检索长度A.为O(log2n)B.为O(n)C.为O(n*log 2020-05-24 …
求给以下算法复杂度排序增长速度由慢到快1)O(n^(3/4))O(log(n)^5)O(2^n)O 2020-07-23 …
如何证明n^3sin(nπ/6)=O(n^4)当n接近无限大是正确的大O符号要求是的|n^3sin 2020-08-01 …
下列加点字注音全部正确的一项是()(2分)A.瞥见(piē)孪生(luán)狡黠(xiá)广袤无垠( 2020-11-10 …
下列四种算法的时间复杂度中,执行时间最短.A.O(n)B.O(log2n)C.O(2n)D.O(n2 2020-12-15 …
下列词语中加点的字,注音全都正确的一组是A.宫绦tāo脑髓suí不着边际zháo繁文缛节rùB.监生 2020-12-26 …