不同物质的溶解度会随温度的变化而发生不同的变化,利用这一性质,我们可以将物质进行分离和提纯。工业上制取硝酸钾就是利用了该原理。请你回答以下问题:1.右图是几种盐
不同物质的溶解度会随温度的变化而发生不同的变化,利用这一性质,我们可以将物质进行分离和提纯。工业上制取
硝酸钾就是利用了该原理。请你回答以下问题:
1.右图是几种盐的溶解度曲线,下列说法正确是
(A)40℃时 将35克食盐溶于100克水中 降温至0℃时 可析 出氯化钠晶体
(B)20℃时 硝酸钾饱和溶液的质量百分比浓度是31.6%
(C)60℃时 200克水中溶解80克硫酸铜达饱和.当降温至30℃时 可析出30克硫酸铜晶体
(D)30℃时 将35克硝酸钾和35克食盐同时溶于100克水中 蒸发时 先析出的是氯化钠
2.从右图曲线中可以分析得到KNO 3 和NaCl的溶解度随温度变化的关系是 。
3.请填写空白。
| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
|
① |
溶解 | 取20克NaNO 3 和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | NaNO 3 和KCl溶于水后产生四种离子,这四种离子可能组成四种物质 、 、 、 。这四种物质在不同温度下的溶解度特点 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 晶体析出。 |
| ③ |
| 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 。 |
| ④ | 冷却 | 将滤液冷却至室温。 | 有 晶体析出。尚有少量的 析出。 |
| ⑤ |
| 按有关要求进行操作 | 得到初产品硝酸钾晶体(称量为m 1 ) |
|
⑥ |
| 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体(称量为m 2 ) |
| ⑦ |
检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1d1mol/l的HNO 3 和2d0.1mol/l的AgNO 3 | 可观察到⑤、⑥产品中出现的现象分别是
|
(1)检验所得产品中是否Cl - 的目的是 。结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为 。(不考虑损失)
(2)步骤③过滤使用了保温漏斗,用图所示装置,其主要作用是
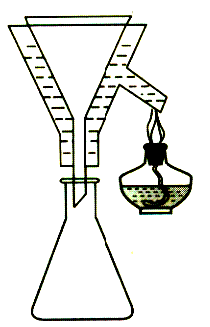
(3)步骤③过滤装置如图1―8所示,采用这种装置过滤的主要目的是 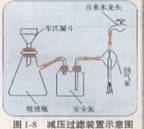
这种装置工作的主要原理是
(4)玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取溶液,上述实验步骤中一般需要用到玻璃棒的是_______________(填代号).
2、随着城市的发展,城市郊区的农业结构将发生变化。下列土地利用类型在该地农业用地中的比重 2020-05-25 …
一企业中Windows2000服务器采用NTFS分区,在该服务器上存在一个文件夹aa;仅有用户use 2020-05-31 …
某企业拟建立一项基金,每年年初投入120000元,若利率为10%,5年后该项基金本利和将企业拟建立 2020-06-21 …
如图为“我国某城镇发展现状和规划示意图”.回答下列问题.(1)该城镇规划的空间形态由集中式向组团式 2020-06-28 …
关于房屋租赁合同的案例分析甲将自己所有的一一间简屋出租给乙使用,乙将该屋用于水果零售,后乙业务发展 2020-07-02 …
已知某局所属12个工业企业的职工人数和工资总额,要求计算该局职工的平均工资,应该采用()A.已知某 2020-07-16 …
据各地报纸报导,在一些建筑工地的食堂里,常发生将工业用盐当作食盐用,引起工人食物中毒的现象,该工业用 2020-11-21 …
据有关报纸报道,在一些建筑工地的食堂里常发生将工业用盐当作食盐用,引起工人食物中毒的现象,该工业用盐 2021-01-04 …
有一些建筑工地的食堂中,常发生将工业用盐当作食盐用,引起工人食物中毒的现象,该工业用盐对人体有致癌作 2021-01-13 …
常发生将工业用盐当作食盐而引起中毒现象,该工业用盐对人有致癌作用,这种盐的化学式是()A.MgCl2 2021-01-13 …