早教吧作业答案频道 -->化学-->
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应
题目详情
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
(1)仪器A中发生反应的化学方程式为___,
(2)装置B中的试剂是___,若撤去装置B,可能导致装置D中副产物___(填化学式)的量增加;装置D可采用___加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为___ 写出E中所有可能发生的无机反应的离子方程式___.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行___,为什么:___.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为___.(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是___
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是___,若撤去装置B,可能导致装置D中副产物___(填化学式)的量增加;装置D可采用___加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为___ 写出E中所有可能发生的无机反应的离子方程式___.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行___,为什么:___.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为___.(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是___
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.

▼优质解答
答案和解析
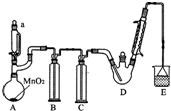
A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl4CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)B装置用饱和食盐水除去HCl,减少副反应发生,撤去B装置,氯气中混有HCl,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生,导致装置D中副产物C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,偏于控制温度,
故答案为:饱和食盐水;C2H5Cl;水浴;
(3)有机物易挥发性,冷凝回流挥发的有机物;EE装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,
故答案为:冷凝回流;Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
(4)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,
故答案为:不可行,CCl3COOH溶于乙醇与CCl3CHO;
(5)根据消耗的Na2S2O3计算
剩余I2的物质的量0.02000mol•L-1×0.02L=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol•L-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为
×100%=66.4%,
故答案为:66.4%;
(6)a.酸性越强,电离程度越大,溶液pH越小;
b.电离程度越大,酸性越强,溶液中离子浓度越大,导电能力越强;
c.酸性越弱,其钠盐的水解程度越大,溶液pH越大.
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故a正确;
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱,三氯乙酸溶液中离子浓度更大,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故b正确;
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大,说明乙酸钠的水解程度更大,则乙酸的酸性比三氯乙酸的弱,故c正确,
故选:abc.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)B装置用饱和食盐水除去HCl,减少副反应发生,撤去B装置,氯气中混有HCl,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生,导致装置D中副产物C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,偏于控制温度,
故答案为:饱和食盐水;C2H5Cl;水浴;
(3)有机物易挥发性,冷凝回流挥发的有机物;EE装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,
故答案为:冷凝回流;Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
(4)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,
故答案为:不可行,CCl3COOH溶于乙醇与CCl3CHO;
(5)根据消耗的Na2S2O3计算
剩余I2的物质的量0.02000mol•L-1×0.02L=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol•L-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为
| 1.8×10-3mol×147.5g/mol |
| 0.4g |
故答案为:66.4%;
(6)a.酸性越强,电离程度越大,溶液pH越小;
b.电离程度越大,酸性越强,溶液中离子浓度越大,导电能力越强;
c.酸性越弱,其钠盐的水解程度越大,溶液pH越大.
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故a正确;
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱,三氯乙酸溶液中离子浓度更大,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强,故b正确;
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大,说明乙酸钠的水解程度更大,则乙酸的酸性比三氯乙酸的弱,故c正确,
故选:abc.
看了 某探究小组设计如图所示装置(...的网友还看了以下:
写出1234的化学式写出567的化学方程式1.盐酸2.氯酸钾3.液溴4.碱式碳酸铜5硝酸银和盐酸反 2020-04-07 …
有40g溶质质量分数为5%的氯化钙溶液,若将其溶质的质量分数增加到10%,应采用的方法是()A.把 2020-04-09 …
写出下列反应的文字表达式及其基本反应类型:①加热氯酸钾和二氧化锰的混合物制取氧气,基本反应类型为氯 2020-05-13 …
有A、B、C三种物质各10g组成的混合物,在一定条件下发生化学反应B+C=2A+D.充分反应后剩余 2020-05-13 …
离子反应2个高锰酸钾和16个盐酸反应生成2个氯化钾,2个氯化锰,5个氯气,8个水,问当有5.6升( 2020-05-16 …
1)73.5克的氯酸钾固体,完全分解后可得到氧气多少摩尔?2)35.5克氯气与1.5克氢气反应,理 2020-05-22 …
实验室中用浓度为36.5%的盐酸和二氧化锰反应制氯气,如果反应中盐酸的利用率为50%,要制取35. 2020-05-23 …
几个化学反应方程式你写得出么?1,白磷和氢氧化钾反应2,氢氧化镁和饱和氯化胺反应3,重铬酸钾和氯化 2020-06-22 …
将36.5克氯化钙和氯化钠的混合物放入236克水中,使其完全溶解,再加入132.5克溶质质量分数为 2020-07-19 …
麻烦写出下面反应的离子方程式.1.碳酸氢钠和醋酸溶液反应.2.碳酸氢钙溶液中加盐酸.3.向氯化亚铁溶 2021-02-08 …