早教吧作业答案频道 -->化学-->
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:NaBr+H2SO4(浓)+C2H5OH△NaHSO4+C2H5Br+H2O已知反应物的用量:0.3molNaBr(s);0.25mol乙
题目详情
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
NaBr+H2SO4(浓)+C2H5OH
NaHSO4+C2H5Br+H2O
已知反应物的用量:0.3mol NaBr(s);0.25mol乙醇;36mL浓硫酸(溶质质量分数为98%,密度为1.84g•mL-1);25mL水,其中乙醇的密度为0.80g•mL-1.回答下列问题:
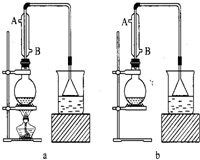
(1)该实验应选择如图中的___(填“a”或“b”)装置.
(2)反应装置中的烧瓶应选择下列哪种规格最合适___
A.50mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是___
A.A进B出 B.B进A出 C.从A进或B进均可
(4)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有___.
(5)用棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是___,必须使用的仪器是___.
(6)本实验的产率为60%,则可制取溴乙烷___g.
(7)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏.
为证明最终得到的产品--溴乙烷中含有溴元素,下列几项实验步骤,其正确的操作顺序是:少量溴乙烷,然后___(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却.
NaBr+H2SO4(浓)+C2H5OH
| △ |
| |
已知反应物的用量:0.3mol NaBr(s);0.25mol乙醇;36mL浓硫酸(溶质质量分数为98%,密度为1.84g•mL-1);25mL水,其中乙醇的密度为0.80g•mL-1.回答下列问题:

(1)该实验应选择如图中的___(填“a”或“b”)装置.
(2)反应装置中的烧瓶应选择下列哪种规格最合适___
A.50mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是___
A.A进B出 B.B进A出 C.从A进或B进均可
(4)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有___.
(5)用棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是___,必须使用的仪器是___.
(6)本实验的产率为60%,则可制取溴乙烷___g.
(7)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏.
为证明最终得到的产品--溴乙烷中含有溴元素,下列几项实验步骤,其正确的操作顺序是:少量溴乙烷,然后___(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却.
▼优质解答
答案和解析
(1)由题给信息,知该反应为:NaBr+H2SO4(浓)+C2H5OH
NaHSO4+C2H5Br+H2O,反应需要加热,所以应采用装置a,
故答案为:a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的
,
V(C2H5OH)=
=14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,
故答案为:C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出.
故答案为:B;
(4)可能发生的副反应有:C2H5OH
C2H4↑+H2O,2C2H5OH
C2H5OC2H5+H2O,2HBr+H2SO4(浓)
Br2+SO2↑+2H2O等,
则反应产物混合液中含有C2H5Br、C2H5OC2H5和Br2,所以将烧瓶中的有机物蒸馏出来,所得馏出液中含有C2H5Br、C2H5OC2H5和Br2.
故答案为:C2H5Br、C2H5OC2H5和Br2;
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用NaOH溶液洗涤除去,溴乙烷难溶于水,可以用分液漏斗分离溴乙烷和水溶液;
故答案为:NaOH溶液;分液漏斗;
(6)已知n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,
反应方程式为:NaBr+H2SO4(浓)+C2H5OH
NaHSO4+C2H5Br+H2O,
则m(溴乙烷)=0.15mol×109g/mol=16.35g,
故答案为:16.35;
(7)溴乙烷与氢氧化钠溶液混合加热,溴乙烷水解生成乙醇和NaBr,然后加硝酸中和多余的碱,再向溶液中加硝酸银,生成浅黄色沉淀,说明含有溴离子,即溴乙烷中含有溴元素,所以正确的操作顺序是④①⑤③②;
故答案为:④①⑤③②.
| △ |
故答案为:a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的
| 2 |
| 3 |
V(C2H5OH)=
| 0.25mol×46g/mol |
| 0.80g/cm3 |
故答案为:C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出.
故答案为:B;
(4)可能发生的副反应有:C2H5OH
| 浓硫酸 |
| 140℃ |
| 浓硫酸 |
| 140℃ |
| △ |
则反应产物混合液中含有C2H5Br、C2H5OC2H5和Br2,所以将烧瓶中的有机物蒸馏出来,所得馏出液中含有C2H5Br、C2H5OC2H5和Br2.
故答案为:C2H5Br、C2H5OC2H5和Br2;
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用NaOH溶液洗涤除去,溴乙烷难溶于水,可以用分液漏斗分离溴乙烷和水溶液;
故答案为:NaOH溶液;分液漏斗;
(6)已知n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,
反应方程式为:NaBr+H2SO4(浓)+C2H5OH
| △ |
则m(溴乙烷)=0.15mol×109g/mol=16.35g,
故答案为:16.35;
(7)溴乙烷与氢氧化钠溶液混合加热,溴乙烷水解生成乙醇和NaBr,然后加硝酸中和多余的碱,再向溶液中加硝酸银,生成浅黄色沉淀,说明含有溴离子,即溴乙烷中含有溴元素,所以正确的操作顺序是④①⑤③②;
故答案为:④①⑤③②.
看了 实验室用NaBr、浓H2SO...的网友还看了以下:
欲除去液溴中溶解的少量氯气,可向其中适量添加溴化钾固体,为什么添加溴化钾固体?原理是什么?主要想问 2020-04-26 …
如图是一个多量程多用电表的简化电路图,测量电流、电压和电阻各有两个量程,当转换开关S旋到位置1时, 2020-05-13 …
如图所示是一个多量程多用电表的简化电路图,测量电流、电压和电阻各有两个量程.当转换开关S旋到位置3 2020-05-13 …
溴乙烷与氰化钠反应的方程式溴乙烷与氨气反应的化学方程式 溴乙烷与氰化钠反应的化学方程式 2020-05-17 …
IBr+H2O=HBr+HIO这个方程式溴化碘的化合价I和Br分别几价A在很多反映中溴化碘是强氧化 2020-07-05 …
(1)图1是一个多量程多用电表的简化电路图,已知表头的内阻Rg=200Ω,满偏电流Ig=2mA,R 2020-07-16 …
制溴苯反应后得到的溴苯中溶有少量苯、溴、三溴苯、溴化铁和溴化氢等杂质,欲除去上述杂质,得到无水溴苯 2020-07-21 …
溴及其化合物广泛应用在有机合成、化学分析等领域.(1)海水提溴过程中溴元素的变化如下:①过程Ⅰ,海 2020-07-24 …
(1)如图甲所示是一个多量程多用电表的简化电路图,测量电流,电压和电阻各有两个量程,当转换开关S旋到 2020-12-05 …
如图为溴元素在元素周期表中的部分信息及溴原子的结构示意图,请回答:溴的相对原子质量为;溴元素位于第周 2021-01-20 …