早教吧作业答案频道 -->化学-->
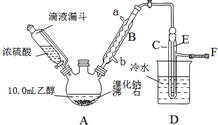
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr△
题目详情
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr
NaHSO4+HBr↑.CH3CH2OH+HBr
CH3CH2Br+H2O.有关数据见表:
(1)A装置的名称是___.
(2)实验中用滴液漏斗代替分液漏斗的优点为___.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式___.
(4)给A加热的目的是___,F接橡皮管导入稀NaOH溶液,其目的主要是___.
(5)图中C中的导管E的末端须在水面以下,其目的是___.
(6)为了除去产品中的主要杂质,最好选择下列___(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的___(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是___.
| ||
| △ |
| |
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点为___.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式___.
(4)给A加热的目的是___,F接橡皮管导入稀NaOH溶液,其目的主要是___.
(5)图中C中的导管E的末端须在水面以下,其目的是___.
(6)为了除去产品中的主要杂质,最好选择下列___(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的___(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是___.

▼优质解答
答案和解析
(1)根据装置图可知A仪器的名称为三颈烧瓶,
故答案为:三颈烧瓶;
(2)滴液漏斗可以使漏斗的上方和下方的压强相等,使浓磷酸顺利流下,而分液漏斗没有这个功能,
故答案为:平衡压强,使浓硫酸顺利流下;
(3)在温度过高或浓硫酸的浓度过大的情况下,浓硫酸与溴化氢发生氧化还原反应生成溴和二氧化硫,会使收集到的粗产品呈橙色,反应方程式为2HBr+H2SO4(浓)
Br2↑+SO2↑+2H2O,
故答案为:2HBr+H2SO4(浓)
Br2↑+SO2↑+2H2O;
(4)加热的目的是加快反应速率,温度高于38.4°C溴乙烷全部挥发蒸馏出来,实验中产生的二氧化硫、溴化氢、溴等会污染空气,所以可以用稀NaOH溶液吸收;
故答案为:升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动;吸收SO2、Br2、HBr防止空气污染;
(5)导管E的末端须在水面以下,通过冷却得到溴乙烷,减少溴乙烷的挥发,提高产率;
故答案为:使溴乙烷充分冷凝,提高产率;
(6)A.氢氧化钠,加氢氧化钠会引起溴乙烷水解,故A错误;
B.除去溴乙烷中的少量杂质Br2,加碘化钾会引入碘单质杂质 故B错误;
C.加亚硫酸钠只与溴反应不与溴乙烷反应,故c正确;
D.碳酸氢钠溶液呈碱性,和溴单质、溴乙烷反应,故D错误;
故选C;
(7)①溴乙烷的密度大于水,所以分液都是从分液漏斗的下口放出,
故答案为:下口;
②10mL乙醇的质量为0.79×10g=7.9g,其物质的量为0.172mol,所以理论制得溴乙烷的物质的量为0.172mol,其质量为18.75g,所以溴乙烷的产率=
×100%=53.3%,
故答案为:53.3%.
故答案为:三颈烧瓶;
(2)滴液漏斗可以使漏斗的上方和下方的压强相等,使浓磷酸顺利流下,而分液漏斗没有这个功能,
故答案为:平衡压强,使浓硫酸顺利流下;
(3)在温度过高或浓硫酸的浓度过大的情况下,浓硫酸与溴化氢发生氧化还原反应生成溴和二氧化硫,会使收集到的粗产品呈橙色,反应方程式为2HBr+H2SO4(浓)
| ||
故答案为:2HBr+H2SO4(浓)
| ||
(4)加热的目的是加快反应速率,温度高于38.4°C溴乙烷全部挥发蒸馏出来,实验中产生的二氧化硫、溴化氢、溴等会污染空气,所以可以用稀NaOH溶液吸收;
故答案为:升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动;吸收SO2、Br2、HBr防止空气污染;
(5)导管E的末端须在水面以下,通过冷却得到溴乙烷,减少溴乙烷的挥发,提高产率;
故答案为:使溴乙烷充分冷凝,提高产率;
(6)A.氢氧化钠,加氢氧化钠会引起溴乙烷水解,故A错误;
B.除去溴乙烷中的少量杂质Br2,加碘化钾会引入碘单质杂质 故B错误;
C.加亚硫酸钠只与溴反应不与溴乙烷反应,故c正确;
D.碳酸氢钠溶液呈碱性,和溴单质、溴乙烷反应,故D错误;
故选C;
(7)①溴乙烷的密度大于水,所以分液都是从分液漏斗的下口放出,
故答案为:下口;
②10mL乙醇的质量为0.79×10g=7.9g,其物质的量为0.172mol,所以理论制得溴乙烷的物质的量为0.172mol,其质量为18.75g,所以溴乙烷的产率=
| 10.0g |
| 18.75g |
故答案为:53.3%.
看了 实验室用乙醇、浓硫酸和溴化钠...的网友还看了以下:
某同学在做完硫酸和氢氧化钠中和反应的实验后,他的猜想是:某同学在做完硫酸和氢氧化钠中和反应的实验后, 2020-03-31 …
钠的化合物在日常生活中应用广泛.(1)碳酸氢钠是发酵粉的成分之一,其俗称是.(2)氯化钠是重要的调 2020-04-08 …
氯化铵和氢氧化钠反应要加热吗 2020-06-29 …
氯化钠是重要的调味品,是舌尖上最不可缺少的味道.下面三幅示意图分别表示不同的化学反应,但生成物中都 2020-07-22 …
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)为常见的两种化合物,其中碳酸钠最为重要,在工业上有 2020-07-27 …
向nmolm氯化铝中滴加mol氢氧化钠溶液,反应生成氢氧化铝,氢氧化铝再和氢氧化钠反应生成偏氯酸钠( 2020-11-27 …
钠在坩埚中燃烧不可以证明的是()A.钠的熔、沸点低B.钠的颜色是银白色的C.钠与空气中氧气反应,条件 2020-12-08 …
氧化钙和硫酸钠反应要用氧化钙排硫酸钠,怎么排不可能直接生成硫酸钙和氢氧化钠吧.能不能帮我分析分析,如 2020-12-12 …
钠单质和钠的重要化合物(氧化钠和过氧化钠)分别与盐酸,水.还有过氧化钠与水反应的化学方程式.(就是与 2021-02-02 …
为什么铝和氢氧化钠反应要和水一起反应! 2021-02-02 …