已知:C2H4(g)+H2O(g)===C2H5OH(g)ΔH=-45.5kJ·mol-1。乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。下图为气相直接
已知: C2H4(g) + H2O(g)===C2H5OH(g) Δ H =- 45.5 kJ · mol - 1 。
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系 ( 其中 nH2O ∶ nC2H4 = 1 ∶ 1) 。
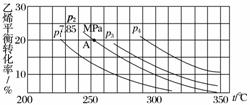
① 列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数 Kp = ________________________________________________________________________
( 用平衡分压代替平衡浓度计算,分压=总压 × 物质的量分数 ) 。
② 图中压强 (p1 、 p2 、 p3 、 p4) 的大小顺序为 __________ ,理由是 ________________________________________________________________________
________________________________________________________________________ 。
③ 气相直接水合法常用的工艺条件为磷酸 / 硅藻土为催化剂,反应温度 290 ℃ 、压强 6.9 MPa , nH2O ∶ nC2H4 = 0.6 ∶ 1 ,乙烯的转化率为 5% ,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 ________________________ 、 ________________________ 。
答案 ① ![]() =
= 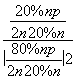 =
= ![]() = 0.07(MPa) - 1
= 0.07(MPa) - 1
② p4>p3>p2>p1 反应分子数减少,相同温度下,压强增大,乙烯转化率提高
③ 将产物乙醇液化移去 增加 nH2O ∶ nC2H4 比
解析 ① Kp = ![]() =
= 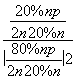 =
= ![]() = 0.07(MPa) - 1
= 0.07(MPa) - 1
② C2H4(g) + H2O(g) C2H5OH(g) 是一个气体体积减小的反应,相同温度下,增大压强,平衡向正反应方向移动, C2H4 的转化率提高,所以 p4>p3>p2>p1 。
③ 依据反应特点及平衡移动原理,提高乙烯转化率还可以增大 H2O 与 C2H4 的比例,将乙醇及时分离出去等。
在密闭容器中,下列可逆反应达到平衡后,升高温度可以使混合气体平均相对分子质量减小的是A.H2(气) 2020-05-17 …
建筑安装工程费用中,利润的计费基础可采用( )。A.直接费+间接费 B.直接工程费+间接费。C.人工 2020-05-18 …
建筑安装工程费用中,利润的计费基础可采用( )。A.直接费+间接费 B.直接工程费+间接费 C.人工 2020-05-18 …
熵增加的判断1、硫+氧气=二氧化硫2、氢气+氧气=双氧水3、碳+水=一氧化碳+氢气三个反应熵增加的 2020-06-04 …
工程造价=( )。 A.合同价+索赔额 B.预算价+增加费用 C.直接费+间接费+利润+税金 D.先 2020-06-07 …
建安工程造价中,利润的计取基础通常有( )。 A.人工费 B.直接费+间接费 C.直接工程费+间 2020-06-07 …
关于铁生锈的机理,有人提出如下步骤:①Fe(固)-2e-→Fe2+;②H++e-→H;③4H+O2 2020-06-19 …
1.下列反应中既为化合反应又为氧化反应的是()A.水→通电→氢气+氧气B.镁+氧气→点燃→氧化镁C 2020-06-23 …
已知:C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol2CO(g)+O2(g)=2 2020-07-18 …
一个小的英语语法点,宾语从句连接词+名词+谓语.连接词在从句中作主语的定语.常见的连接词有:who 2020-07-28 …