早教吧作业答案频道 -->化学-->
氯元素的单质及其化合物在生产生活中应用极其广泛.请完成下列填空:Ⅰ:氯气性质探究设计如图实验装置来制备并验证氯气的性质(部分夹持装置未画出).(1)A中放置固体二氧化锰
题目详情
氯元素的单质及其化合物在生产生活中应用极其广泛.请完成下列填空:
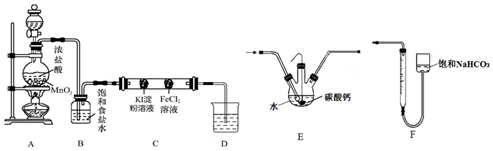
Ⅰ:氯气性质探究
设计如图实验装置来制备并验证氯气的性质(部分夹持装置未画出).
(1)A中放置固体二氧化锰的装置名称是___.
(2)装置B的作用是___.
(3)硬质玻璃管C中事先装有两个沾有相关试剂的棉球,左侧棉球的实验现象为___.
(4)D中的NaOH溶液用来吸收尾气,向反应后的D中加入足量稀硫酸会产生气体,写出该反应的离子方程式___.
Ⅱ:制备HClO
(5)设计装置E代替如图的装置C,用于制备较高浓度的HClO溶液.在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙.
①该方案可以制得较高浓度HClO的原因是(结合必要的化学语言回答)___.
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除HClO外,还含有___、___(写两种钙盐的化学式,一种正盐,一种酸式盐);该小组同学测得反应中碳酸钙质量减少M g,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),则原溶液中含钙正盐的浓度为___mol•L-1(用含M、V的代数式表示).

Ⅰ:氯气性质探究
设计如图实验装置来制备并验证氯气的性质(部分夹持装置未画出).
(1)A中放置固体二氧化锰的装置名称是___.
(2)装置B的作用是___.
(3)硬质玻璃管C中事先装有两个沾有相关试剂的棉球,左侧棉球的实验现象为___.
(4)D中的NaOH溶液用来吸收尾气,向反应后的D中加入足量稀硫酸会产生气体,写出该反应的离子方程式___.
Ⅱ:制备HClO
(5)设计装置E代替如图的装置C,用于制备较高浓度的HClO溶液.在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙.
①该方案可以制得较高浓度HClO的原因是(结合必要的化学语言回答)___.
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除HClO外,还含有___、___(写两种钙盐的化学式,一种正盐,一种酸式盐);该小组同学测得反应中碳酸钙质量减少M g,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),则原溶液中含钙正盐的浓度为___mol•L-1(用含M、V的代数式表示).
▼优质解答
答案和解析
Ⅰ:氯气性质探究
(1)装置A是制备氯气的发生装置,二氧化锰为固体和滴入的盐酸加热反应生成氯气,盛放二氧化锰的仪器为圆底烧瓶,故答案为:圆底烧瓶;
(2)生成的氯气含有水蒸气和氯化氢,氯化氢极易溶于水,氯化钠溶液中氯离子抑制氯气和水的反应,通过饱和食盐水除去氯化氢气体杂质,
故答案为:除去氯气中的氯化氢;
(3)氯气有氧化性可以氧化碘化钾生成碘单质,2KI+Cl2=I2+2KCl,碘单质遇到淀粉变蓝色,故答案为:变蓝色;
(4)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,加入酸发生归中反应生成氯气,反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
Ⅱ.(5)①该方案可以制得较高浓度HClO的原因是溶液中存在化学平衡:Cl2+H2O H++Cl-+HClO,碳酸钙与H+反应,使平衡向右移动,HClO浓度增大,得到较高浓度HClO,
故答案为:Cl2+H2O⇌H++Cl-+HClO,碳酸钙与H+反应,使平衡向右移动,HClO浓度增大;
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,说明溶液中含有碳酸氢钙,是生成的二氧化碳和碳酸钙反应生成的碳酸氢钙,所以溶液中存在次氯酸、氯化钙、次氯酸钙;该小组同学测得反应中碳酸钙质量减少M g为碳酸钙,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),依据反应定量关系,CaCO3~Ca(HCO3)2~2CO2计算200ml溶液中生成二氧化碳的碳酸钙质量=(
×
)mol×
×100g/mol,则原溶液中含钙正盐的浓度=
=
-
,
故答案为:CaCl2、Ca(HCO3)2、
-
.
(1)装置A是制备氯气的发生装置,二氧化锰为固体和滴入的盐酸加热反应生成氯气,盛放二氧化锰的仪器为圆底烧瓶,故答案为:圆底烧瓶;
(2)生成的氯气含有水蒸气和氯化氢,氯化氢极易溶于水,氯化钠溶液中氯离子抑制氯气和水的反应,通过饱和食盐水除去氯化氢气体杂质,
故答案为:除去氯气中的氯化氢;
(3)氯气有氧化性可以氧化碘化钾生成碘单质,2KI+Cl2=I2+2KCl,碘单质遇到淀粉变蓝色,故答案为:变蓝色;
(4)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,加入酸发生归中反应生成氯气,反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
Ⅱ.(5)①该方案可以制得较高浓度HClO的原因是溶液中存在化学平衡:Cl2+H2O H++Cl-+HClO,碳酸钙与H+反应,使平衡向右移动,HClO浓度增大,得到较高浓度HClO,
故答案为:Cl2+H2O⇌H++Cl-+HClO,碳酸钙与H+反应,使平衡向右移动,HClO浓度增大;
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,说明溶液中含有碳酸氢钙,是生成的二氧化碳和碳酸钙反应生成的碳酸氢钙,所以溶液中存在次氯酸、氯化钙、次氯酸钙;该小组同学测得反应中碳酸钙质量减少M g为碳酸钙,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),依据反应定量关系,CaCO3~Ca(HCO3)2~2CO2计算200ml溶液中生成二氧化碳的碳酸钙质量=(
| V |
| 22.4 |
| 1 |
| 2 |
| 200 |
| 10 |
M-
| ||
| 100g/mol×0.2L |
| M |
| 20 |
| V |
| 0.448 |
故答案为:CaCl2、Ca(HCO3)2、
| M |
| 20 |
| V |
| 0.448 |
看了 氯元素的单质及其化合物在生产...的网友还看了以下:
为研究“绿豆种子的呼吸作用”,某同学将一定量萌发的绿豆种子平均分成两份(其中一份煮熟),同时分别放 2020-05-17 …
为研究“绿豆种子的呼吸”,某同学将一定量萌发的绿豆种子平均分成两份(其中一份煮熟),同时分别放入如 2020-05-17 …
放满一个水池的水,如果同时开放123号阀门,15小时可以放满,如果同时开放135号阀门10小时可以 2020-06-14 …
用斜线(/)给下面短文中画线部分断句。孟子言求放心,而康节邵子曰:心要能放。二者天渊悬绝。盖放心者 2020-06-28 …
甲乙两个同样大的油罐,如果他们每分钟都放油5KG,那么甲罐中的油52分钟放完,乙罐中的油36分钟放 2020-07-04 …
如何上香:1.用自己的火将香点燃;2.用两手的中指和食指夹着香杆,大姆指顶着香的尾部;3.安置胸前 2020-07-06 …
阅读短文,回答问题捕鼠夹如图是捕鼠夹的工作原理图.从侧面看它是三根互相制约的杠杆,F1是弹簧作用于 2020-07-24 …
有一质量分布均匀的工件,正放时如图甲所示,倒放时如图乙所示,现要用力沿箭头方向将它推翻,变成如图丙方 2020-10-31 …
静电环怎么测好坏,我今天买了个静电环.用万用表测夹子端和环金属端不通啊!静电环原理是不是就是靠环上金 2020-11-21 …
在光滑水平面上放有如图所示的用绝缘材料制成的“┙”型滑板,其质量为m1=40kg,在滑板右端A壁左侧 2020-12-22 …