早教吧作业答案频道 -->化学-->
为了比较铝与相同pH的稀盐酸和稀硫酸反应的快慢,某化学兴趣小组做了如下探究实验.(1)铝与稀硫酸反应的化学方程式为.(2)x=,选择此数值的理由.实验过程中,可以通过观
题目详情
为了比较铝与相同pH的稀盐酸和稀硫酸反应的快慢,某化学兴趣小组做了如下探究实验.
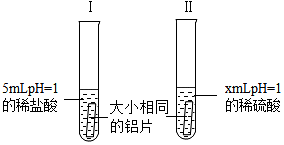
(1)铝与稀硫酸反应的化学方程式为___.
(2)x=___,选择此数值的理由___.实验过程中,可以通过观察___来比较铝与稀盐酸和稀硫酸反应的剧烈程度.
(3)实验过程中,发现铝与稀盐酸反应更加剧烈,同学们提出了以下猜想:
猜想一:试管Ⅰ中氯离子对反应起了促进作用;
猜想二:试管Ⅱ中硫酸根离子对反应起了阻碍作用;
猜想三:以上两种猜想同时成立.
为了验证上述猜想是否正确,向试管Ⅰ中加入少量___(填序号),向试管Ⅱ中加入少量___(填序号),作对比实验.
A.硫酸铜 B.氯化钠 C.硫酸钠 D.浓盐酸
(4)通过(3)中的对比实验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则___猜想成立.

(1)铝与稀硫酸反应的化学方程式为___.
(2)x=___,选择此数值的理由___.实验过程中,可以通过观察___来比较铝与稀盐酸和稀硫酸反应的剧烈程度.
(3)实验过程中,发现铝与稀盐酸反应更加剧烈,同学们提出了以下猜想:
猜想一:试管Ⅰ中氯离子对反应起了促进作用;
猜想二:试管Ⅱ中硫酸根离子对反应起了阻碍作用;
猜想三:以上两种猜想同时成立.
为了验证上述猜想是否正确,向试管Ⅰ中加入少量___(填序号),向试管Ⅱ中加入少量___(填序号),作对比实验.
A.硫酸铜 B.氯化钠 C.硫酸钠 D.浓盐酸
(4)通过(3)中的对比实验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则___猜想成立.
▼优质解答
答案和解析
(1)铝和稀硫酸反应生成硫酸铝和氢气,反应的化学方程式为:2Al+3H2SO4═Al2(SO4)3+3H2↑.
(2)因为对比试验只能有一个变量,所以x=5,实验过程中,可以通过观察气泡产生的快慢来比较铝与稀盐酸和稀硫酸反应的剧烈程度.
(3)为了验证上述猜想是否正确,向试管Ⅰ中加入少量硫酸钠后反应速度无变化,则Na+、SO42-对实验没有影响.
向试管Ⅱ中加入少量氯化钠反应明显加快,综合可知Na+对实验没影响,所以影反应速率的是Cl-.
(4)过(3)中的对比试验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则猜想一成立.
答案:
(1)2Al+3H2SO4═Al2(SO4)3+3H2↑.
(2)5;对比实验只能有一个变量;气泡产生的快慢;
(3)C;B;
(4)一.
(2)因为对比试验只能有一个变量,所以x=5,实验过程中,可以通过观察气泡产生的快慢来比较铝与稀盐酸和稀硫酸反应的剧烈程度.
(3)为了验证上述猜想是否正确,向试管Ⅰ中加入少量硫酸钠后反应速度无变化,则Na+、SO42-对实验没有影响.
向试管Ⅱ中加入少量氯化钠反应明显加快,综合可知Na+对实验没影响,所以影反应速率的是Cl-.
(4)过(3)中的对比试验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则猜想一成立.
答案:
(1)2Al+3H2SO4═Al2(SO4)3+3H2↑.
(2)5;对比实验只能有一个变量;气泡产生的快慢;
(3)C;B;
(4)一.
看了 为了比较铝与相同pH的稀盐酸...的网友还看了以下:
一个商店以批发价购进96元西红柿,如果全部以每斤0.6元卖出,可以赚百分之二十五,可是除了一部分质 2020-05-13 …
一个商店以批发价购进96元西红柿,如果全部全部以每斤0.6元卖出,可以赚二成五,可是除了一部分质量 2020-05-13 …
1.一菜贩从菜市场购进200元的西红柿,如果全部以每千克1.4元卖出,可以赚40%.由于天气的因素 2020-05-13 …
一菜贩从市场购进200元,西红柿如果全部以每千克1.4元卖出可以赚4成.由于气候因素,除了一部分质 2020-05-23 …
VTEC系统同时控制气门正时和气门升程,以实现根据不同的工况,提供发动机相应的( )从而提高汽车的 2020-05-31 …
已知函数y=f(x)是奇函数,其图像与x轴有3个交点,则方程f(x)=0的所以实数之根是 2020-06-02 …
英语翻译我们的照片是实物拍摄的,所以实物和照片上是相同的.只要我们收到钱后,我们就会立刻发货.我们 2020-06-22 …
《十二铜表法》规定了“同态复仇”:指氏族、部落成员遭到外伤害时,受害者给对方以同样的方式,按受伤害 2020-06-22 …
《十二铜表法》规定了“同态复仇”:指氏族、部落成员遭到外来伤害时,受害者给对方以同样的方式,按受伤 2020-06-22 …
求为这篇作文拟一个题目和提纲每个人都会有理想,理想是美好的.理想的得以实现需要我们付出行动.正所谓 2020-06-29 …