早教吧作业答案频道 -->化学-->
蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验流程如图1所示:(1)蛇纹石加盐酸溶解后,溶液有Mg2+等种金属离子产生,写出产生Mg2+的化学方程式.(2)
题目详情
蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验流程如图1所示: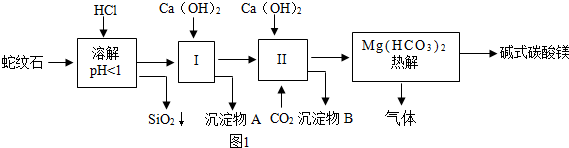
(1)蛇纹石加盐酸溶解后,溶液有Mg2+等___种金属离子产生,写出产生Mg2+的化学方程式___.(2)进行Ⅰ操作时,控制溶液pH=6~7(有关氢氧化物沉淀的pH见表),沉淀物A中含有___和___.该操作中Ca(OH)2不能过量,若Ca(OH)2过量,溶液pH会升高,可能导致___溶解,___会沉淀析出.
(3)已知Mg(HCO3)2受热分解可以产生三种氧化物,请写出该反应方程式___.
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是___.
(5)确定产品碱式碳酸镁(mMgCO3•nMg(OH)2•xH2O)的组成.某同学组装仪器如图2所示:
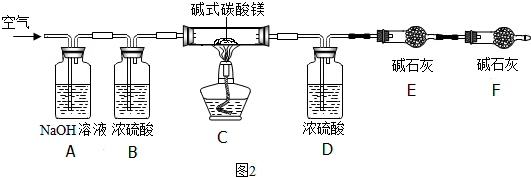
【资料查询】MgCO3、Mg(OH)2受热易分解,各生成对应的两种氧化物.
实验测得:硬质玻璃管中剩余的固体质量为2.0g,D处浓H2SO4增重0.9g,E处碱石灰增重1.76g.
①A装置中NaOH溶液的作用是___;B装置中药品是___;在实验中要持续通入空气,其目的是___.
②通过计算可得碱式碳酸镁(mMgCO3•nMg(OH)2•xH2O)中m:n=___.x值为___.若将F装置去掉,对实验结果的影响是m值___(填“偏大”、“偏小”或“不变”).

(1)蛇纹石加盐酸溶解后,溶液有Mg2+等___种金属离子产生,写出产生Mg2+的化学方程式___.(2)进行Ⅰ操作时,控制溶液pH=6~7(有关氢氧化物沉淀的pH见表),沉淀物A中含有___和___.该操作中Ca(OH)2不能过量,若Ca(OH)2过量,溶液pH会升高,可能导致___溶解,___会沉淀析出.
| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | 沉淀不溶 | 沉淀不溶 |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| Mg(OH)2 | 8.6 | 11.1 | 沉淀不溶 | 沉淀不溶 |
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是___.
(5)确定产品碱式碳酸镁(mMgCO3•nMg(OH)2•xH2O)的组成.某同学组装仪器如图2所示:

【资料查询】MgCO3、Mg(OH)2受热易分解,各生成对应的两种氧化物.
实验测得:硬质玻璃管中剩余的固体质量为2.0g,D处浓H2SO4增重0.9g,E处碱石灰增重1.76g.
①A装置中NaOH溶液的作用是___;B装置中药品是___;在实验中要持续通入空气,其目的是___.
②通过计算可得碱式碳酸镁(mMgCO3•nMg(OH)2•xH2O)中m:n=___.x值为___.若将F装置去掉,对实验结果的影响是m值___(填“偏大”、“偏小”或“不变”).
▼优质解答
答案和解析
(1)蛇纹石加盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去.故答案为:3;MgO+2HCl=MgCl2+H2O;
(2)根据题干中沉淀形成的pH可知,当溶液pH=6~7时,氢氧化铁和氢氧化铝会沉淀析出;若Ca(OH)2过量,溶液pH会升高,pH超过7.8时,氢氧化铝沉淀开始溶解,到达8.6时,氢氧化镁沉淀形成;故填:Fe(OH)3、Al(OH)3;Al(OH)3;Mg(OH)2;
(3)碳酸氢镁受热分解为氧化镁、二氧化碳和水,故填:Mg(HCO3)2
MgO+2CO2↑+H2O;
(4)从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到CO2,可以循环使用的物质是:CO2;故答案为:CO2;
(5)①氢氧化钠溶液可以吸收空气中的二氧化碳,避免对后面检验二氧化碳、水造成干扰,所以A框中装置的作用是:除去空气中的二氧化碳;B中的浓硫酸具有吸水性,是为了除去空气中的水蒸气;故填:除去空气中的二氧化碳;除去空气中的水蒸气;使得碱式碳酸镁分解产生的二氧化碳和水蒸气被完全排出;
②硬质玻璃管中剩余的固体质量为2.0g,C处浓H2SO4增重0.9g,所以m(H2O)=0.9g,D处碱石灰增重1.76g,所以m(CO2)=1.76g,
mMgCO3nMg(OH)2xH2O
(m+n)MgO+mCO2↑+(n+x)H2O↑,
80(m+n) 44m 18(n+x)
2g 1.76g 0.9g
=
=
解之得:m=4,n=1,x=4,
所以碱式碳酸镁的化学式为:4MgCO3•Mg(OH)2•4H2O;
装置F去掉,空气中的二氧化碳和水蒸气会增加碱石灰和浓硫酸的质量,所以对实验结果的影响是m值偏大,x值偏大;故填:4:1;4;偏大.
(2)根据题干中沉淀形成的pH可知,当溶液pH=6~7时,氢氧化铁和氢氧化铝会沉淀析出;若Ca(OH)2过量,溶液pH会升高,pH超过7.8时,氢氧化铝沉淀开始溶解,到达8.6时,氢氧化镁沉淀形成;故填:Fe(OH)3、Al(OH)3;Al(OH)3;Mg(OH)2;
(3)碳酸氢镁受热分解为氧化镁、二氧化碳和水,故填:Mg(HCO3)2
| ||
(4)从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到CO2,可以循环使用的物质是:CO2;故答案为:CO2;
(5)①氢氧化钠溶液可以吸收空气中的二氧化碳,避免对后面检验二氧化碳、水造成干扰,所以A框中装置的作用是:除去空气中的二氧化碳;B中的浓硫酸具有吸水性,是为了除去空气中的水蒸气;故填:除去空气中的二氧化碳;除去空气中的水蒸气;使得碱式碳酸镁分解产生的二氧化碳和水蒸气被完全排出;
②硬质玻璃管中剩余的固体质量为2.0g,C处浓H2SO4增重0.9g,所以m(H2O)=0.9g,D处碱石灰增重1.76g,所以m(CO2)=1.76g,
mMgCO3nMg(OH)2xH2O
| ||
80(m+n) 44m 18(n+x)
2g 1.76g 0.9g
| 80(m+n) |
| 2g |
| 44m |
| 1.76g |
| 18(n+x) |
| 0.9g |
解之得:m=4,n=1,x=4,
所以碱式碳酸镁的化学式为:4MgCO3•Mg(OH)2•4H2O;
装置F去掉,空气中的二氧化碳和水蒸气会增加碱石灰和浓硫酸的质量,所以对实验结果的影响是m值偏大,x值偏大;故填:4:1;4;偏大.
看了 蛇纹石矿可以看做MgO、Fe...的网友还看了以下:
小勇在涪江边拾到一块鹅卵石,他想知道这块鹅卵石的密度.于是他找来天平、量筒按表格中的顺序进行了测量 2020-05-14 …
科学原创与经典同学们在语文课中,曾经学过诗人于谦写的《石灰吟》,诗中描写了石灰生产的原料来源、生产 2020-06-11 …
中东所产石油90%供出口的原因有()①产油国人口少,石油消费量小②产油国不用石油③产油国工业不发达 2020-06-20 …
科学原创与经典同学们在语文课中,曾经学过诗人于谦写的《石灰吟》,诗中描写了石灰生产的原料来源、生产 2020-06-21 …
我市著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板.原理是:发电过程中产生的烟气中含有 2020-07-07 …
石灰粘水就发热的原理?普遍来看,石灰是烧过干燥后粘水就发热、可我想知道石头烧过冷却后还是石头,加水这 2020-11-16 …
石灰在工农业生产和建筑业有着重要用途.用于生产石灰的主要原料是石灰石(其主要成份为A),在石灰窑中加 2020-11-20 …
我昨天做梦看见天空远处一块好大"陨石"从天而降,一个奇妙的壮观,天空中一个大火球.我昨天做梦看见天空 2020-11-27 …
下列说法中不正确的是()。A.石油化学工业是以石油为原料,既生产石油产品又生产化学用品的石油加工业B 2020-12-01 …
选出下列各项中注音不合规范的一项:()A.戥子děng谛听dì答复dá阽危diànB.妨碍fáng拊 2020-12-29 …