早教吧作业答案频道 -->化学-->
氢化镁(MgH2)既可用于劣质燃料的助燃又可同时脱硫脱硝.有关原理如下:MgH2(s)⇌Mg(s)+H2(g)△H12Mg(s)+O2(g)⇌2MgO(s)△H22MgO(s)+2SO2(g)⇌2MgSO4(s)△H3(1)①MgH2的电子式为
题目详情
氢化镁(MgH2)既可用于劣质燃料的助燃又可同时脱硫脱硝.有关原理如下:
MgH2(s)⇌Mg(s)+H2(g)△H1
2Mg(s)+O2(g)⇌2MgO(s)△H2
2MgO(s)+2SO2(g)⇌2MgSO4(s)△H3
(1)①MgH2的电子式为___.
②反应:SO2(g)+MgH2(s)+O2⇌MgSO4(s)+H2(g)的△H=___(用含△H1、△H2、△H3
的代数式表示).
(2)1300℃时,不同微粒的MgH2分解时放氢容量与时间的关系如图1所示.
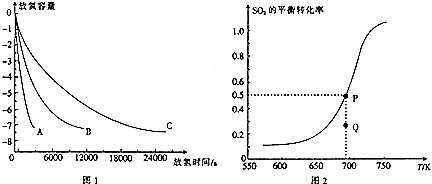
则粒径A、B、C从小到大的顺序是___.
(3)在2L的恒容密闭容器中加入1molMgO、1molSO2和0.5molO2,发生反应:2MgO(s)+2SO2(g)+O2(g)⇌2MgSO4(s)△H3,测得SO2的平衡转化率与温度的关系如图2所示.
①该反应的△H3___(填“>”或“<“,下同)0;Q点的反应速率:v(正)___v(逆).
②P点对应温度下该反应的平衡常数为___.
③为提高SO2的转化率,除改变温度外,还可采取的措施有___(任写2点).
(4)镁铝合金(Mg17Ar12)是一种贮氢合金,完全吸氢时生成氢化镁和金属铝,该吸氢反应的化学方程式为___.7.32gMg17Ar12完全吸氢后所得的产物与足量稀H2SO4反应,释放出的氢气在标准状况下的体积为___.
MgH2(s)⇌Mg(s)+H2(g)△H1
2Mg(s)+O2(g)⇌2MgO(s)△H2
2MgO(s)+2SO2(g)⇌2MgSO4(s)△H3
(1)①MgH2的电子式为___.
②反应:SO2(g)+MgH2(s)+O2⇌MgSO4(s)+H2(g)的△H=___(用含△H1、△H2、△H3
的代数式表示).
(2)1300℃时,不同微粒的MgH2分解时放氢容量与时间的关系如图1所示.

则粒径A、B、C从小到大的顺序是___.
(3)在2L的恒容密闭容器中加入1molMgO、1molSO2和0.5molO2,发生反应:2MgO(s)+2SO2(g)+O2(g)⇌2MgSO4(s)△H3,测得SO2的平衡转化率与温度的关系如图2所示.
①该反应的△H3___(填“>”或“<“,下同)0;Q点的反应速率:v(正)___v(逆).
②P点对应温度下该反应的平衡常数为___.
③为提高SO2的转化率,除改变温度外,还可采取的措施有___(任写2点).
(4)镁铝合金(Mg17Ar12)是一种贮氢合金,完全吸氢时生成氢化镁和金属铝,该吸氢反应的化学方程式为___.7.32gMg17Ar12完全吸氢后所得的产物与足量稀H2SO4反应,释放出的氢气在标准状况下的体积为___.
▼优质解答
答案和解析
(1)①MgH2为离子化合物,电子式为[H:]-Mg2+[H:]-,故答案为:[H:]-Mg2+[H:]-;
②ⅠMgH2(s)⇌Mg(s)+H2(g)△H1
Ⅱ2Mg(s)+O2(g)⇌2MgO(s)△H2
Ⅲ2MgO(s)+2SO2(g))+O2(g)⇌2MgSO4(s)△H3
根据盖斯定律,Ⅰ+
(Ⅱ+Ⅲ)得SO2(g)+MgH2(s)+O2⇌MgSO4(s)+H2(g)的△H=△H1+
(△H2+△H3),故答案为:△H1+
(△H2+△H3);
(2)因为粒径越小,接触面积越大,反应速率越快,由图象可知,反应速率A>B>C,所以粒径A、B、C从小到大的顺序是A<B<C,故答案为:A<B<C;
(3)①根据图象测得SO2的平衡转化率随温度升高而增大,说明升温平衡正向移动即吸热方向移动,则△H3<0;Q点的SO2的转化率小于平衡点,所以仍然向正向移动,则v(正)>v(逆),故答案为:<;>;
②由图可知P点SO2的转化率为0.5,所以平衡时剩余0.5molSO2和0.25molO2,又K=
=
=128,故答案为:128;
③提高SO2的转化率,可以改变温度、压强以及增大氧气的量使平衡正向进行,所以除改变温度外,还可采取的措施有增大压强或者增大氧气的量,故答案为:增大压强或者增大氧气的量;
(4)Mg17Al12与氢气反应生成氢化镁和金属铝,化学方程式为:Mg17Al12+17H2=17MgH2+12Al,所以7.32g即
=0.01molMg17Al12生成0.17molMgH2和0.12mol金属铝,又氢化镁和金属铝与足量稀H2SO4反应方程式分别为:MgH2+H2SO4=MgSO4+2H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,所以生成氢气在标准状况下的体积为(0.17mol×2+0.12mol×
)×22.4L/mol=11.648L,故答案为:Mg17Al12+17H2=17MgH2+12Al;11.648L.
②ⅠMgH2(s)⇌Mg(s)+H2(g)△H1
Ⅱ2Mg(s)+O2(g)⇌2MgO(s)△H2
Ⅲ2MgO(s)+2SO2(g))+O2(g)⇌2MgSO4(s)△H3
根据盖斯定律,Ⅰ+
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(2)因为粒径越小,接触面积越大,反应速率越快,由图象可知,反应速率A>B>C,所以粒径A、B、C从小到大的顺序是A<B<C,故答案为:A<B<C;
(3)①根据图象测得SO2的平衡转化率随温度升高而增大,说明升温平衡正向移动即吸热方向移动,则△H3<0;Q点的SO2的转化率小于平衡点,所以仍然向正向移动,则v(正)>v(逆),故答案为:<;>;
②由图可知P点SO2的转化率为0.5,所以平衡时剩余0.5molSO2和0.25molO2,又K=
| 1 |
| c(SO 2) 2c(O 2) |
| 1 | ||||
(
|
③提高SO2的转化率,可以改变温度、压强以及增大氧气的量使平衡正向进行,所以除改变温度外,还可采取的措施有增大压强或者增大氧气的量,故答案为:增大压强或者增大氧气的量;
(4)Mg17Al12与氢气反应生成氢化镁和金属铝,化学方程式为:Mg17Al12+17H2=17MgH2+12Al,所以7.32g即
| 7.32g |
| 732g/mol |
| 3 |
| 2 |
看了 氢化镁(MgH2)既可用于劣...的网友还看了以下:
因搬家要把一质量为300kg钢琴从阳台上降落到地面.用一绳吊着钢琴先以0.5m/s匀速降落,当钢琴底 2020-03-31 …
光合作用中,用水(含氧18)浇植物,氧18是如何到二氧化碳中的.光合作用用的水都产生了氧气,但有氧 2020-05-17 …
硝酸和双氧水反应吗?反应式是什么如果在合金粉中加了硝酸,反应后又加了双氧水,双氧水是和合金粉反应还 2020-05-17 …
把一质量为300kg的物体从阳台降落到地面,用一绳吊着以0.5m/s匀速降落.当物体距地面高为h时 2020-05-20 …
线粒体上的FeS(铁硫蛋白)能不能传递H线粒体上的FeS(铁硫蛋白)是A.递H+体B.递电子体C. 2020-06-05 …
如图所示,水平固定的小圆盘A,带电量为Q,电势为零,从盘心处O由静止释放一质量为m带电量为+q的小 2020-06-12 …
发电厂的热电比怎么计算现有工程总蒸汽产生量为515t/h,,其中用于发电(凝气)耗用蒸汽为234t 2020-06-25 …
两道大学热力学思考题“理想气体在恒外压下绝热膨胀,因为恒外压,所以Qp=△H;又因绝热,所以Qp= 2020-07-05 …
将一质量为m的小球竖直向上抛出,小球上升h后又落回地面,在整个过程中受到的空气阻力大小始终为f,则 2020-07-14 …
动动脑,猜一猜。小小姑娘黑(hēi)又黑,秋天飞去春天回。房子建(jiàn)在屋子里,带着剪(jiǎ 2021-01-17 …