早教吧作业答案频道 -->化学-->
砷(33As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防腐剂、染料和医药等领域,及其多种合金中.(1)砷原子次外层上的电子数为,砷化氢的电子式为.(2)成语“
题目详情
砷(33As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防腐剂、染料和医药等领域,及其多种合金中.
(1)砷原子次外层上的电子数为___,砷化氢的电子式为___.
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒.As2O3是两性偏酸性的氧化物,写出As2O3溶于浓盐酸的化学方程式___.
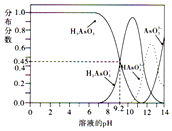
(3)As2O3溶于热水生成的亚砷酸(H3AsO3),具有较强的还原性,分可用于治疗白血病,其水溶液存在多种微粒形态,各微粒的分布分数与溶液pH的关系如图:
①向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,反应的离子方程式为___.
②电离平衡常数Ka1(H3AsO3)=___.
③Na2HAsO3溶液呈碱性,该溶液中c(H2AsO3-)___c(AsO33-)(填“>”、“<”或“=”).
④向含有HAsO32-的溶液中滴加氯水反应的离子方程式为___.

(1)砷原子次外层上的电子数为___,砷化氢的电子式为___.
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒.As2O3是两性偏酸性的氧化物,写出As2O3溶于浓盐酸的化学方程式___.
(3)As2O3溶于热水生成的亚砷酸(H3AsO3),具有较强的还原性,分可用于治疗白血病,其水溶液存在多种微粒形态,各微粒的分布分数与溶液pH的关系如图:
①向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,反应的离子方程式为___.
②电离平衡常数Ka1(H3AsO3)=___.
③Na2HAsO3溶液呈碱性,该溶液中c(H2AsO3-)___c(AsO33-)(填“>”、“<”或“=”).
④向含有HAsO32-的溶液中滴加氯水反应的离子方程式为___.
▼优质解答
答案和解析
(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,次外层为3s23p63d10,所以砷原子次外层上的电子数为18,AsH3的结构中3个H原子和As原子间形成3条共价键,电子式为: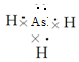 ,
,
故答案为:18;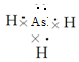 ;
;
(2)砒霜(As2O3)是两性偏酸性的氧化物,和酸反应体现碱性氧化物的性质,和盐酸反应生成AsCl3、H2O,反应方程式为:As2O3+6HCl=2AsCl3+3H2O,
故答案为:As2O3+6HCl=2AsCl3+3H2O;
(3)①根据各微粒的分布分数与溶液pH的关系图可知,pH=11时,生成H2AsO3-,所以向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,离子方程式为:H3AsO3+OH-=H2AsO3-+H2O,
故答案为:H3AsO3+OH-=H2AsO3-+H2O;
②电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,H3AsO3的第一级电离方程式为H3AsO3⇌H++H2AsO3-,图象中pH=9.2时,H3AsO3和H2AsO3-浓度相同,K=
=10-9.2,
故答案为:10-9.2;
③Na2HAsO3溶液呈碱性,说明H2AsO3-以水解为主,所以该溶液中c(H2AsO3-)>c(AsO33-),
故答案为:>;
④HAsO32-中的As显+3价,具有还原性,氯水中的氯气具有氧化性,两者发生氧化还原反应,As(+3→+5),Cl(0→-1),根据得失电子守恒和原子守恒,离子方程式为:HAsO32-+H2O+Cl2=H3AsO4+2Cl-,
故答案为:HAsO32-+H2O+Cl2=H3AsO4+2Cl-.
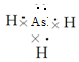 ,
,故答案为:18;
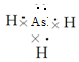 ;
;(2)砒霜(As2O3)是两性偏酸性的氧化物,和酸反应体现碱性氧化物的性质,和盐酸反应生成AsCl3、H2O,反应方程式为:As2O3+6HCl=2AsCl3+3H2O,
故答案为:As2O3+6HCl=2AsCl3+3H2O;
(3)①根据各微粒的分布分数与溶液pH的关系图可知,pH=11时,生成H2AsO3-,所以向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,离子方程式为:H3AsO3+OH-=H2AsO3-+H2O,
故答案为:H3AsO3+OH-=H2AsO3-+H2O;
②电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,H3AsO3的第一级电离方程式为H3AsO3⇌H++H2AsO3-,图象中pH=9.2时,H3AsO3和H2AsO3-浓度相同,K=
| C(H+)•C(H2ASO3-) |
| C(H3ASO3) |
故答案为:10-9.2;
③Na2HAsO3溶液呈碱性,说明H2AsO3-以水解为主,所以该溶液中c(H2AsO3-)>c(AsO33-),
故答案为:>;
④HAsO32-中的As显+3价,具有还原性,氯水中的氯气具有氧化性,两者发生氧化还原反应,As(+3→+5),Cl(0→-1),根据得失电子守恒和原子守恒,离子方程式为:HAsO32-+H2O+Cl2=H3AsO4+2Cl-,
故答案为:HAsO32-+H2O+Cl2=H3AsO4+2Cl-.
看了 砷(33As)在元素周期表中...的网友还看了以下:
海洋国土日益为临海国家重视,读下图,根据所学知识判断下列不正确的选项。大陆架与经济专属区示意图A. 2020-05-16 …
砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是()A.砷在通常状况下为固 2020-11-01 …
砷(As)与其化合物被广泛应用在除草剂、杀虫剂以及含砷药物中.回答下列问题:(1)砷是氮的同族元素. 2020-11-01 …
我国在砷化镓太阳能电池研究方面国际领先.砷(As)和镓(Ga)都是第四周期元素,分别属于ⅤA和ⅢA族 2020-11-01 …
我国在砷化镓太阳能电池研究方面国际领先.砷(As)和镓(Ga)都是第四周期元素,分别属于ⅤA和ⅢA族 2020-11-01 …
已知元素砷(As)的原子序数为33,下列叙述正确的是()A.砷元素的最高化合价为+3B.砷元素是第五 2020-11-01 …
下列关于砷(As)元素的叙述中,正确的是A.第一电离能:As<Se,电负性As<SeB.在AsCl3 2020-11-01 …
2012年6月16日我国成功发射神州九号载人宇宙飞船,飞船的太阳能电池板有“飞船血液”之称,它可将太 2020-11-01 …
下列关于砷(As)元素的叙述中,正确的是()A.在AsCl3分子中,砷原子最外层电子数为8且中心原子 2020-11-01 …
海带中的“砷”对人体有害,通常需要浸泡24小时才能除去.根据如图提供的砷的有关信息,下列说法中正确的 2020-12-14 …