早教吧作业答案频道 -->化学-->
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO.B2O3.H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如图1:表一:硼酸在不同温度下的溶解度(s)温度20
题目详情
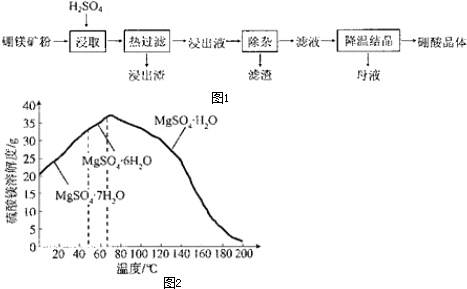
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO.B2O3.H2O、SiO2及少量Fe3O4、CaCO3、Al2O3 )为原料生产硼酸的工艺流程如图1:
表一:硼酸在不同温度下的溶解度(s)
表二:金属阳离子以氢氧化物形式完全沉淀时(c≤1.0×10-5mol•L-1)的pH
(1)写出2MgO•B2O3•H2O浸取生成H3BO3的化学方程式:___;
(2)除杂操作过程中加入MgO调节溶液pH的目的___;
(3)“浸取”后,采用“热过滤”的目的是___,浸出渣的成分___;
(4)根据题中所给条件计算Fe(OH)3的Kap值___;
(5)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图2所示,且溶液的沸点随压强增大而升高.为了从“母液”中充分回收 MgSO4.H2O,应采取的操作是___.
a.加压升温结晶b.降温结晶c.蒸发结晶.

表一:硼酸在不同温度下的溶解度(s)
| 温度 | 20℃ | 40℃ | 60℃ | 100℃ |
| 溶解度(s) | 5.0g | 8.7g | 14.8g | 40.2g |
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| pH | 3.0 | 5.2 | 9.7 | 12.4 |
(2)除杂操作过程中加入MgO调节溶液pH的目的___;
(3)“浸取”后,采用“热过滤”的目的是___,浸出渣的成分___;
(4)根据题中所给条件计算Fe(OH)3的Kap值___;
(5)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图2所示,且溶液的沸点随压强增大而升高.为了从“母液”中充分回收 MgSO4.H2O,应采取的操作是___.
a.加压升温结晶b.降温结晶c.蒸发结晶.
▼优质解答
答案和解析
由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,趁热过滤,防止H3BO3从溶液中析出,“除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH约为5.2,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3,
(1)根据元素守恒可写知2MgO•B2O3•H2O浸取生成H3BO3的化学方程式为2MgO•B2O3•H2O+2H2SO4=2MgSO4+2H3BO3,
故答案为:2MgO•B2O3•H2O+2H2SO4=2MgSO4+2H3BO3;
(2)浸出液中有Al3+、Fe3+杂质,需要通过调节溶液pH值除去杂质且不引入新的杂质,所以加入MgO调节溶液pH的目的是除去溶液中的Al3+、Fe3+杂质,
故答案为:除去溶液中的Al3+、Fe3+杂质;
(3)由题目信息可知:H3BO3的溶解度随温度的升高而增大,所以要采用“热过滤”,以防温度下降时H3BO3从溶液中析出,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,所以浸出渣的成分是SiO2、CaSO4,
故答案为:防止温度下降时H3BO3从溶液中析出;SiO2、CaSO4;
(4)根据题中所给条件,氢氧化物形式完全沉淀时(c≤1.0×10-5mol•L-1),pH=3.0,此时溶液中c(OH-)=10-11,所以Fe(OH)3的Ksp=c(Fe3+)•c3(OH-)=1.0×10-5×(10-11)3=1×10-38,
故答案为:1×10-38;
(5)根据MgSO4.H2O的溶解度随温度变化的曲线可知,温度越高,MgSO4.H2O溶解度越小,所以从“母液”中充分回收 MgSO4.H2O,应采取加压升温结晶的方法,
故选a.
(1)根据元素守恒可写知2MgO•B2O3•H2O浸取生成H3BO3的化学方程式为2MgO•B2O3•H2O+2H2SO4=2MgSO4+2H3BO3,
故答案为:2MgO•B2O3•H2O+2H2SO4=2MgSO4+2H3BO3;
(2)浸出液中有Al3+、Fe3+杂质,需要通过调节溶液pH值除去杂质且不引入新的杂质,所以加入MgO调节溶液pH的目的是除去溶液中的Al3+、Fe3+杂质,
故答案为:除去溶液中的Al3+、Fe3+杂质;
(3)由题目信息可知:H3BO3的溶解度随温度的升高而增大,所以要采用“热过滤”,以防温度下降时H3BO3从溶液中析出,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,所以浸出渣的成分是SiO2、CaSO4,
故答案为:防止温度下降时H3BO3从溶液中析出;SiO2、CaSO4;
(4)根据题中所给条件,氢氧化物形式完全沉淀时(c≤1.0×10-5mol•L-1),pH=3.0,此时溶液中c(OH-)=10-11,所以Fe(OH)3的Ksp=c(Fe3+)•c3(OH-)=1.0×10-5×(10-11)3=1×10-38,
故答案为:1×10-38;
(5)根据MgSO4.H2O的溶解度随温度变化的曲线可知,温度越高,MgSO4.H2O溶解度越小,所以从“母液”中充分回收 MgSO4.H2O,应采取加压升温结晶的方法,
故选a.
看了 硼酸(H3BO3)大量应用于...的网友还看了以下:
物质在水中的溶解度溶解度的四要素:条件标准溶解状态单位2.溶解度的意义:3.固体物质溶解度与温度变 2020-04-08 …
pH=2的溶液,其H+浓度为0.01mol/L,下列四种情况中的溶液:①25℃的溶液②100℃的溶 2020-06-12 …
将某温度下的饱和石灰水:①加入少量生石灰后恢复的原来温度;②降低温度.这两种情况下,前后均保持不变 2020-06-27 …
对水垢的主要成分是CaC03和Mg(OH)2而不是CaC03和MgC03的原因解释,其中正确的有A 2020-07-10 …
如图是Ca(OH)2的溶解度曲线.下列有关说法错误的是()A.在30℃时,Ca(OH)2的溶解度约 2020-07-10 …
常温下Ca(OH)2的溶解度为0.148g,其溶于水达饱和时存在如下关系:常温下Ca(OH)2的溶 2020-07-18 …
1.100克浓度为25%的食盐水,若想达到40%,需加盐多少克?2:有浓度为20%的酒精溶液150 2020-07-26 …
根据Mg(OH)2的溶度积(Kθsp(Mg(OH)2)=2.7×10-11)计算:(1)Mg(OH) 2020-11-01 …
瓶子里装有浓度为15%酒精3000克,现倒入300克和1200克的A、B两种酒精溶液后,浓度为14% 2020-11-08 …
查阅文献,在25℃的水溶液中,Mg(OH)2的溶度积常数是5×10-12,Ca(OH)2的溶度积常数 2020-12-14 …