早教吧作业答案频道 -->化学-->
硼及其化合物在现代工业、生活和国防中有重要应用价值.(1)硼原子的电子排布式是.(2)最简单的硼烷是B2H6(乙硼烷),结构见图,其中B原子的杂化方式为.(3)BF3和BCl3都有强
题目详情
硼及其化合物在现代工业、生活和国防中有重要应用价值.
(1)硼原子的电子排布式是___.
(2)最简单的硼烷是B2H6(乙硼烷),结构见图,其中B原子的杂化方式为___.
(3)BF3和BCl3都有强烈接受孤电子对的倾向,如三氟化硼气体与氨气相遇,立即生成白色固体,写出该白色固体结构式,并标注出其中的配位键___.
(4)近年来,人们肯定硼是人和动物氟中毒的重要解毒剂.硼在体内可与氟形成稳定的配合物___
___,并以和氟相同的途径参加体内代谢,但毒性比氟小,且易随尿排出,故认为硼对氟化物具有解毒作用.
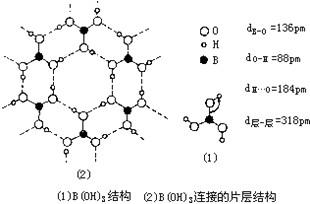
(5)经结构研究证明,硼酸晶体中B(OH)3单元结构如图(1)所示.各单元中的氧原子通过O-H…O氢键连结成层状结构如图(2)所示.层与层之间以微弱的分子间力相结合构成整个硼酸晶体.
①H3BO3是一元弱酸,写出它与水反应的化学方程式___,
②根据结构判断下列说法正确的是___.
a.硼酸晶体属于原子晶体 b.硼酸晶体有鳞片状的外层
c.硼酸晶体是分子晶体 d.硼酸晶体有滑腻感,可作润滑剂
e.在B(OH)3单元中,B原子以sp3杂化轨道和氧原子结合而成
f.H3BO3分子的稳定性与氢键有关
g.含1mol H3BO3的晶体中有3mol氢键
h.分子中硼原子最外层为8e-稳定结构
③硼酸常温下为白色片状晶体,溶于水(273K时溶解度为6.35),在热水中溶解度明显增大(373K时为27.6).请分析其中原因___.

(1)硼原子的电子排布式是___.
(2)最简单的硼烷是B2H6(乙硼烷),结构见图,其中B原子的杂化方式为___.
(3)BF3和BCl3都有强烈接受孤电子对的倾向,如三氟化硼气体与氨气相遇,立即生成白色固体,写出该白色固体结构式,并标注出其中的配位键___.
(4)近年来,人们肯定硼是人和动物氟中毒的重要解毒剂.硼在体内可与氟形成稳定的配合物___
___,并以和氟相同的途径参加体内代谢,但毒性比氟小,且易随尿排出,故认为硼对氟化物具有解毒作用.
(5)经结构研究证明,硼酸晶体中B(OH)3单元结构如图(1)所示.各单元中的氧原子通过O-H…O氢键连结成层状结构如图(2)所示.层与层之间以微弱的分子间力相结合构成整个硼酸晶体.
①H3BO3是一元弱酸,写出它与水反应的化学方程式___,
②根据结构判断下列说法正确的是___.
a.硼酸晶体属于原子晶体 b.硼酸晶体有鳞片状的外层
c.硼酸晶体是分子晶体 d.硼酸晶体有滑腻感,可作润滑剂
e.在B(OH)3单元中,B原子以sp3杂化轨道和氧原子结合而成
f.H3BO3分子的稳定性与氢键有关
g.含1mol H3BO3的晶体中有3mol氢键
h.分子中硼原子最外层为8e-稳定结构
③硼酸常温下为白色片状晶体,溶于水(273K时溶解度为6.35),在热水中溶解度明显增大(373K时为27.6).请分析其中原因___.
▼优质解答
答案和解析
(1)B元素为5号元素,原子核外有5个电子,分两层排布,第一层2个,第二层3个,所以核外电子排布式为:1s22s22p1,
故答案为:1s22s22p1;
(2)乙硼烷分子中每个硼原子含有4个共价键,所以B原子采用sp3杂化,
故答案为:sp3杂化;
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,BF3能与NH3反应生成BF3•NH3,B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对,BF3•NH3结构式为: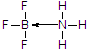 ,
,
故答案为:BF3•NH3;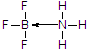 ;
;
(4)缺电子化合物具有很强的接受电子的能力,硼与氟元素形成的BF3为缺电子化合物与氟离子形成BF4-,硼元素具有缺电子性,所以硼在体内可与氟形成稳定的配合物BF4-,
故答案为:BF4-;
(5)①硼酸为一元弱酸,在水溶液里,和水电离出的氢氧根离子形成配位键,其电离方程式为:H3BO3+H2O⇌[B(OH)4]-+H+,
故答案为:H3BO3+H2O⇌[B(OH)4]-+H+;
②a.硼酸晶体中存在H3BO3分子,且该晶体中存在氢键,说明硼酸由分子构成,是分子晶体,原子晶体内只有共价键,故a错误;
b.硼酸(H3BO3)是一种片层状结构白色晶体,层内的“H3BO3”微粒之间通过氢键相连,故b正确;
c.硼酸晶体中存在H3BO3分子,硼酸晶体是分子晶体,故c正确;
d.硼酸(H3BO3)是一种片层状结构白色晶体,片层状结构晶体有滑腻感,可作润滑剂,故d正确;
e.在B(OH)3单元中,B只形成了3个单键,没有孤电子对,所以采取sp2杂化,故e错误;
f.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,故f错误;
g.1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,故g正确;
h.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,故h错误;
故答案为:bcdg;
③晶体内氢键不利于物质溶解,加热破坏了硼酸晶体内分子之间的氢键,所以加热时,硼酸的溶解度增大,
故答案为:受热时硼酸晶体中的大量氢键有部分断裂所致,晶体内氢键不利于物质溶解.
故答案为:1s22s22p1;
(2)乙硼烷分子中每个硼原子含有4个共价键,所以B原子采用sp3杂化,
故答案为:sp3杂化;
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,BF3能与NH3反应生成BF3•NH3,B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对,BF3•NH3结构式为:
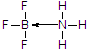 ,
,故答案为:BF3•NH3;
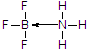 ;
;(4)缺电子化合物具有很强的接受电子的能力,硼与氟元素形成的BF3为缺电子化合物与氟离子形成BF4-,硼元素具有缺电子性,所以硼在体内可与氟形成稳定的配合物BF4-,
故答案为:BF4-;
(5)①硼酸为一元弱酸,在水溶液里,和水电离出的氢氧根离子形成配位键,其电离方程式为:H3BO3+H2O⇌[B(OH)4]-+H+,
故答案为:H3BO3+H2O⇌[B(OH)4]-+H+;
②a.硼酸晶体中存在H3BO3分子,且该晶体中存在氢键,说明硼酸由分子构成,是分子晶体,原子晶体内只有共价键,故a错误;
b.硼酸(H3BO3)是一种片层状结构白色晶体,层内的“H3BO3”微粒之间通过氢键相连,故b正确;
c.硼酸晶体中存在H3BO3分子,硼酸晶体是分子晶体,故c正确;
d.硼酸(H3BO3)是一种片层状结构白色晶体,片层状结构晶体有滑腻感,可作润滑剂,故d正确;
e.在B(OH)3单元中,B只形成了3个单键,没有孤电子对,所以采取sp2杂化,故e错误;
f.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,故f错误;
g.1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,故g正确;
h.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,故h错误;
故答案为:bcdg;
③晶体内氢键不利于物质溶解,加热破坏了硼酸晶体内分子之间的氢键,所以加热时,硼酸的溶解度增大,
故答案为:受热时硼酸晶体中的大量氢键有部分断裂所致,晶体内氢键不利于物质溶解.
看了 硼及其化合物在现代工业、生活...的网友还看了以下:
10.如图9-38甲、乙两斜面高度相同,但长度不同(L甲>L乙)今把重力相同的两个物体从斜面底端以 2020-05-13 …
某校课外阅读小组,每位同学均定了甲、乙两份杂志.甲杂志是月刊,每月一期定价是三元,乙杂志是双月刊, 2020-05-21 …
如图,L甲、L乙分别是甲、乙两弹簧的长ycm与所挂物体质量xkg之间函数关系的图象,设甲弹簧每挂1 2020-06-17 …
初二数学某校课外阅读小组,每位同学均订了甲乙两份杂志。甲杂志是月刊,每月一期定价是3元,乙杂志是双 2020-07-08 …
如图是常见四种有机物的比例模型示意图.下列说法正确的是()A.甲中有少量乙杂质,可以通入到酸性高锰 2020-07-12 …
下列关于有机化合物的叙述中正确的是()A.KMnO4酸性溶液既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯 2020-11-03 …
下列关于乙烷、乙烯、乙炔的叙述中正确的是()A.π键数:乙烷>乙烯>乙炔B.α键数:乙烷>乙烯>乙炔 2020-11-29 …
甲、乙、丙三根镍铬合金丝,其横截面积关系S甲>S乙=S丙,长度关系为L甲=L乙<L丙。将它们分别接在 2020-11-29 …
如图,图1、图2、图3分别表示甲、乙、丙三人由A地到B地的路线图(箭头表示行进的方向),其中E为AB 2020-12-05 …
9、如图,L甲、L乙分别表示甲、乙两名运动员在自行车比赛中所走路程与时间的关系,则它们的平均速度的关 2021-01-29 …