早教吧作业答案频道 -->化学-->
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池.磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:方法一:将碳酸锂、乙
题目详情
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池.磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
方法三:某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂.其主要工艺流程如图:

已知:2LiAl(SiO3)2+H2SO4(浓)
Li2SO4+Al2O3•4SiO2•H2O↓
请回答下列问题:
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2O___(填化学式)等气体生成.
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为___
(3)在方法三中,从滤渣Ⅰ中可分离出Al2O3,如图所示.

①请写出生成沉淀的离子方程式___
②滤渣Ⅱ的主要成分是:___(填化学式).
③写出在高温下生成磷酸亚铁锂的化学方程式___.
(4)在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一的结构简式如下: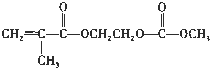 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:___.
,写出该单体与足量氢氧化钠溶液反应的化学方程式:___.
(5)磷酸铁锂动力电池(简称LFP)是一种高效、长寿命的二次电池,其工作原理为:C6Li+FePO4
C6Li(1-x)+(1-x)FePO4+xLiFePO4,电池充电时,阳极中的Li+通过聚合物隔膜向阴极迁移;在放电时,负极中Li+的通过隔膜向正极迁移.充电时的阴极反应式___,若用该电池电解精炼铜,阴极质量增重12.8g,则电池中经过聚合物隔膜的Li+数目为___.
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
方法三:某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂.其主要工艺流程如图:

已知:2LiAl(SiO3)2+H2SO4(浓)
| ||
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2O___(填化学式)等气体生成.
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为___
(3)在方法三中,从滤渣Ⅰ中可分离出Al2O3,如图所示.

①请写出生成沉淀的离子方程式___
②滤渣Ⅱ的主要成分是:___(填化学式).
③写出在高温下生成磷酸亚铁锂的化学方程式___.
(4)在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一的结构简式如下:
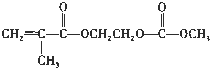 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:___.
,写出该单体与足量氢氧化钠溶液反应的化学方程式:___.(5)磷酸铁锂动力电池(简称LFP)是一种高效、长寿命的二次电池,其工作原理为:C6Li+FePO4
| 放电 |
| |
| 充电 |
▼优质解答
答案和解析
方法三:2LiAl(SiO3)2+H2SO4(浓)
Li2SO4+Al2O3•4SiO2•H2O↓,冷却加水过滤得到滤液I和滤渣I,滤渣中含有Al2O3•4SiO2•H2O↓,滤液中含有Li2SO4、MgSO4、CaSO4,向滤液中加入NaOH、Na2CO3,镁离子和NaOH反应生成氢氧化镁沉淀,钙离子和碳酸钠反应生成碳酸钙沉淀,所以滤渣II为Mg(OH)2、CaCO3,滤液中含有硫酸锂,向滤液中加入饱和碳酸钠得到碳酸锂沉淀,铁和磷酸反应生成磷酸铁,C、磷酸铁和碳酸锂在高温下反应生成LiFePO4;
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2O,该反应中铵根离子生成氨气、碳酸根离子生成二氧化碳,所以生成的物质中还含有的气体是CO2、NH3,故答案为:CO2、NH3;
(2)在方法二中,阳极上Fe失电子和磷酸二氢根离子、锂离子反应生成磷酸亚铁锂,电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+,
故答案为:Fe+H2PO4-+Li+-2e-=LiFePO4+2H+;
(3)在方法三中,从滤渣Ⅰ溶于酸得到铝离子,氢氧化铝不溶于弱碱但能溶于强碱,所以a为氨水,向溶液中加入氨水得到Al(OH)3沉淀,灼烧Al(OH)3沉淀得到Al2O3;
①铝离子和一水合氨反应生成Al(OH)3沉淀,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3,故答案为:Mg(OH)2、CaCO3;
③在高温下生成磷酸亚铁锂,根据反应物、生成物和反应条件书写方程式为2FePO4+Li2CO3+2C
2LiFePO4+3CO↑,
故答案为:2FePO4+Li2CO3+2C
2LiFePO4+3CO↑;
(4)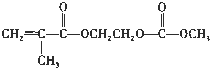 中含有酯基,能和NaOH反应生成酸式盐和醇,反应方程式为
中含有酯基,能和NaOH反应生成酸式盐和醇,反应方程式为 ,故答案为:
,故答案为: ;
;
(5)磷酸铁锂动力电池(简称LFP)工作原理为:C6Li+FePO4
C6Li(1-x)+(1-x)FePO4+xLiFePO4,充电时的阴极上C6Li(1-x)得电子发生还原反应,阴极反应式为C6Li(1-x)+xLi++xe-═C6Li,若用该电池电解精炼铜,阴极质量增重12.8g,则阴极析出n(Cu)=
=0.2mol,铜离子得到的电子物质的量=0.2mol×2=0.4mol,根据电荷守恒则电池中通过聚合物隔膜的Li+数目为0.4NA,
故答案为:C6Li(1-x)+xLi++xe-═C6Li; 0.4NA.
| ||
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2O,该反应中铵根离子生成氨气、碳酸根离子生成二氧化碳,所以生成的物质中还含有的气体是CO2、NH3,故答案为:CO2、NH3;
(2)在方法二中,阳极上Fe失电子和磷酸二氢根离子、锂离子反应生成磷酸亚铁锂,电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+,
故答案为:Fe+H2PO4-+Li+-2e-=LiFePO4+2H+;
(3)在方法三中,从滤渣Ⅰ溶于酸得到铝离子,氢氧化铝不溶于弱碱但能溶于强碱,所以a为氨水,向溶液中加入氨水得到Al(OH)3沉淀,灼烧Al(OH)3沉淀得到Al2O3;
①铝离子和一水合氨反应生成Al(OH)3沉淀,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3,故答案为:Mg(OH)2、CaCO3;
③在高温下生成磷酸亚铁锂,根据反应物、生成物和反应条件书写方程式为2FePO4+Li2CO3+2C
| ||
故答案为:2FePO4+Li2CO3+2C
| ||
(4)
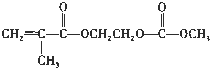 中含有酯基,能和NaOH反应生成酸式盐和醇,反应方程式为
中含有酯基,能和NaOH反应生成酸式盐和醇,反应方程式为 ,故答案为:
,故答案为: ;
;(5)磷酸铁锂动力电池(简称LFP)工作原理为:C6Li+FePO4
| 放电 |
| 充电 |
| 12.8g |
| 64g/mol |
故答案为:C6Li(1-x)+xLi++xe-═C6Li; 0.4NA.
看了 新型锂离子电池在新能源的开发...的网友还看了以下:
请问这个电源是额定功率和最大功率是多少呢?+5V 33A+12V 25A+3.3V 33A-12V 2020-05-16 …
电流是怎样形成的,方向如何方向呢?电子在电源中由负极向正级移动,那电流方向与电子运动方向相同吗? 2020-05-19 …
有关化学电源方面的问题1.密闭的化学电源中电极反应能不能生成气体?2.心脏起搏器以Pt和Zn为电极 2020-05-20 …
化学电源中,电子是从负极流向正极的电解中负离子是向阳极移动的但是这样就不对了啊,电流就不是一个流向 2020-07-13 …
图3中,A、B、C是三相交流电源的三根相线,O是中性线,电源的相电压为220V,L1、L2、L3是 2020-07-25 …
电源正负流向在电路图中,一组电源中,正级流向一块电路板,负极流向另一块电路板说明什么?是这两块电路板 2020-10-31 …
下列发展中的化学电源中不属于充电电池的是()A.铅蓄电池B.锂离子电池C.锌锰电池D.镍镉电池 2020-11-01 …
怎么将逻辑笔的电源夹子夹到被测电路的任一电源点,另一个夹子夹到被测电路的公共接地端我想知道操作过程, 2020-11-21 …
电源中的电流直流电源上如果标识12V2A是什么意思?12V就是输出电压12V.那2A电流是什么意思呢 2020-12-13 …
电源中的正电荷的移动?电源里的正极具有大量地正电荷当其被金属导体接通后电源里的正电荷会在电场力的作用 2020-12-15 …