早教吧作业答案频道 -->化学-->
海水中含有丰富的镁资源.锂(Li)与镁元素性质相似.(1)物质的量为0.10mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是;(2)锂电池
题目详情
海水中含有丰富的镁资源.锂(Li)与镁元素性质相似.
(1)物质的量为0.10mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是___;
(2)锂电池是新一代高能电池,目前已研究成功多种锂电池.某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6
CoO2+LiC6,则放电时电池的正极反应为___.
(3)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂.
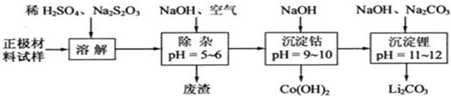
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为___.
②调整PH=5-6的目的是___.
(1)物质的量为0.10mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是___;
(2)锂电池是新一代高能电池,目前已研究成功多种锂电池.某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6
| 充电 |
| 放电 |
(3)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂.

①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为___.
②调整PH=5-6的目的是___.
▼优质解答
答案和解析
(1)锂条在只含有CO2和O2混合气体的容器中燃烧,固体的质量包括为未反应锂的质量、生成的碳的质量和生成的氧化锂的质量,
采用极限思维法,
如果生成固体质量最大,则假设无二氧化碳,锂完全与氧气反应,
4Li+O2
2Li2O,
4 2
0.10mol 0.050mol
则0.1mol锂最多可生成固体的质量为0.050mol×30g/mol=1.5g,
再假设只有锂,则固体最少,固体质量为0.10mol×7g/mol=0.7克,
则固体的范围应该在0.7g<m<1.5g之间,
故答案为:0.7g<m<1.5g;
(2)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,
故答案为:CoO2+Li++e-=LiCoO2;
(3)正极材料(主要含有LiCoO2及少量Al、Fe等)溶于稀硫酸,Fe、Al和稀硫酸反应生成硫酸盐和氢气,发生的离子反应方程式为Fe+2H+=Fe2++H2↑、2Al+6H+=2Al3++3H2↑,酸性条件下S2O32-被氧化成SO42-,所以硫代硫酸钠和LiCoO2反应方程式为8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O;然后向溶液中充入空气,亚铁离子不稳定,易被氧化为铁离子,同时向溶液中加入NaOH溶液,发生的反应为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,所以调节溶液的pH为5-6时,铁离子、铝离子完全沉淀,过滤得到的废渣为 Fe(OH)3、Al(OH)3;过滤后向溶液中再加入NaOH溶液并调节溶液的pH为9-10,发生的离子反应为Co2++2OH-=Co(OH)2↓,过滤得到Co(OH)2,最后向滤液中加入NaOH、Na2CO3并调节溶液的pH为11-12,发生的离子反应为2Li++CO32-=Li2CO3↓,再结合题目分析解答,
①根据题意知,酸性条件下,S2O32ˉ被氧化成SO42ˉ,则LiCoO2被氧化生成Co2+,所以发生的离子反应方程式为:Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4,
故答案为:Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4;
②充入空气的目的是将亚铁离子氧化为铁离子,调节溶液的PH=5-6除去铁离子和铝离子,
故答案为:使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去.
采用极限思维法,
如果生成固体质量最大,则假设无二氧化碳,锂完全与氧气反应,
4Li+O2
| ||
4 2
0.10mol 0.050mol
则0.1mol锂最多可生成固体的质量为0.050mol×30g/mol=1.5g,
再假设只有锂,则固体最少,固体质量为0.10mol×7g/mol=0.7克,
则固体的范围应该在0.7g<m<1.5g之间,
故答案为:0.7g<m<1.5g;
(2)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,
故答案为:CoO2+Li++e-=LiCoO2;
(3)正极材料(主要含有LiCoO2及少量Al、Fe等)溶于稀硫酸,Fe、Al和稀硫酸反应生成硫酸盐和氢气,发生的离子反应方程式为Fe+2H+=Fe2++H2↑、2Al+6H+=2Al3++3H2↑,酸性条件下S2O32-被氧化成SO42-,所以硫代硫酸钠和LiCoO2反应方程式为8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O;然后向溶液中充入空气,亚铁离子不稳定,易被氧化为铁离子,同时向溶液中加入NaOH溶液,发生的反应为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,所以调节溶液的pH为5-6时,铁离子、铝离子完全沉淀,过滤得到的废渣为 Fe(OH)3、Al(OH)3;过滤后向溶液中再加入NaOH溶液并调节溶液的pH为9-10,发生的离子反应为Co2++2OH-=Co(OH)2↓,过滤得到Co(OH)2,最后向滤液中加入NaOH、Na2CO3并调节溶液的pH为11-12,发生的离子反应为2Li++CO32-=Li2CO3↓,再结合题目分析解答,
①根据题意知,酸性条件下,S2O32ˉ被氧化成SO42ˉ,则LiCoO2被氧化生成Co2+,所以发生的离子反应方程式为:Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4,
故答案为:Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4;
②充入空气的目的是将亚铁离子氧化为铁离子,调节溶液的PH=5-6除去铁离子和铝离子,
故答案为:使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去.
看了 海水中含有丰富的镁资源.锂(...的网友还看了以下:
有M克10%的KNO3溶液,今要使其溶质的质量分数增大到20%可以采取的措施是 2020-04-09 …
有m克结晶水合物R*aH20,受热后失去全部结晶水,变为n克,由此计算该结晶水合物的相对分子质量2 2020-05-13 …
现有m克某气体,它由双原子分子构成,它的摩尔质量为M克每摩,若阿伏加德罗常数用NA(A小些)表示, 2020-06-28 …
下列说法能用质量守恒定律解释的是()A.拧开盛酒精的瓶盖一段时间后酒精质量变小B.M克水受热变为M 2020-07-18 …
基础化学有关基本单元的一道题求解析有m克NaOH,当基本单元分别为NaOH,1/2NaOH,2Na 2020-07-24 …
五四运动能够取得初步胜利的最主要原因在于()A.青年学生起了先锋作用B.运动后期工人阶级成为主力军C 2020-11-30 …
2003年2月14日,克隆羊“多莉”因肺部感染而死,比普通羊的寿命短.你对此的看法是()A.有关克隆 2020-12-20 …
(2011•宁阳县一模)2003年2月14日,克隆羊“多莉”因肺部感染而死,比普通羊的寿命短.你对此 2020-12-20 …
2003年2月14日,克隆羊“多莉”因肺部感染而死,比普通羊的寿命短。你对此的看法是()A.有关克隆 2020-12-20 …
和早期工人运动相比,19世纪晚期工人运动的突出特点是[]A.有马克思主义理论的正确领导B.工人政党建 2021-01-01 …