早教吧作业答案频道 -->化学-->
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)⇌WI2(g)△H<0.(1)该反应的平衡常数表达式K=.(2)在恒温恒容条件下,能够说明上述反应一定达到平衡状态的是
题目详情
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)⇌WI2(g)△H<0.
(1)该反应的平衡常数表达式K=___.
(2)在恒温恒容条件下,能够说明上述反应一定达到平衡状态的是___(填代号).
a.I2(g)与WI2(g)的浓度相等 b.W的质量不再变化
c.容器内混合气体的密度保持不变 d.容器内混合气体的压强保持不变
(3)在一定温度下,若平衡常数K=
,向2L恒容密闭容器中加入lmol I2(g)和足量W(s),5min后反应达到平衡.则0-5min内的平均反应速率v(WI2)=___,平衡时I2(g)的转化率为___.相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是___(填代号).
a.平衡常数 b.达到平衡的时间 c.I2的物质的量浓度 d.平衡时WI2的体积分数
(4)为提高该反应的反应速率,同时使
增大,可采取的措施为___.
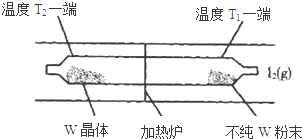
(5)工业上利用上述反应原理提纯金属钨的示意图如图:
反应在石英真空管中进行,先在温度为T1的一端放入未提纯的W粉末和少量I2(g),一段时间后,在温度为T2的一端得到了纯净的晶体,则温度T1___T2(填“>”‘<”或“=”).上述反应体系中循环使用的物质是___.

(1)该反应的平衡常数表达式K=___.
(2)在恒温恒容条件下,能够说明上述反应一定达到平衡状态的是___(填代号).
a.I2(g)与WI2(g)的浓度相等 b.W的质量不再变化
c.容器内混合气体的密度保持不变 d.容器内混合气体的压强保持不变
(3)在一定温度下,若平衡常数K=
| 1 |
| 3 |
a.平衡常数 b.达到平衡的时间 c.I2的物质的量浓度 d.平衡时WI2的体积分数
(4)为提高该反应的反应速率,同时使
| c(I2) |
| c(WI2) |
(5)工业上利用上述反应原理提纯金属钨的示意图如图:
反应在石英真空管中进行,先在温度为T1的一端放入未提纯的W粉末和少量I2(g),一段时间后,在温度为T2的一端得到了纯净的晶体,则温度T1___T2(填“>”‘<”或“=”).上述反应体系中循环使用的物质是___.
▼优质解答
答案和解析
(1)①可逆反应W(s)+I2(g)⇌WI2(g)的平衡常数k=
,故答案为:
;
(2)a.平衡时I2与WI2浓度关系与转化率有关,二者浓度不一定相等,故a错误;
b.随反应进行,W质量分数变化,若W的质量不再变化,说明到达平衡,故b正确;
c.随反应进行,混合气体的质量发生变化,恒容条件下密度也在不断变化,若容器内混合气体的密度保持不变,说明反应达到平衡,故c正确;
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等,反应过程中压强始终不变,不能说明达到平衡,故d错误,
故答案为:bc;
(3)设反应的碘单质物质的量为x
W(s)+I2(g)⇌WI2(g)
起始量(mol) 1 0
变化量(mol) x x
平衡量(mol) 1-x x
K=
=
x=0.25mol
则0-5min内的平均反应速率v(WI2)=
=
=0.025mol/(L•min),
平衡时I2(g)的转化率=
×100%=
×100%=25%;
反应前后气体物质的量不变,加入碘单质物质的量为原来的2倍,I2的物质的量浓度为原来的2倍,平衡常数随温度变化,浓度增大达到平衡的时间短,最后达到的平衡相同,故选c;
故答案为:0.025mol/(L•min);25%;c;
(4)为提高该反应的反应速率,同时使
增大,说明平衡逆向进行,反应是放热反应,升温增大反应速率,平衡逆向进行,故答案为:升高温度;
(5)由图可知,在高温条件下得到纯的W晶体,即升高温度平衡向逆反应方向移动,正反应为放热反应,即△H<0,通过题意温度T2端利于反应正向进行,为低温,温度T1端利于反应向左进行,为高温,所以T1>T2;反应体系中I2可循环使用,
故答案为:>;I2.
| [WI2] |
| [I2] |
| [WI2] |
| [I2] |
(2)a.平衡时I2与WI2浓度关系与转化率有关,二者浓度不一定相等,故a错误;
b.随反应进行,W质量分数变化,若W的质量不再变化,说明到达平衡,故b正确;
c.随反应进行,混合气体的质量发生变化,恒容条件下密度也在不断变化,若容器内混合气体的密度保持不变,说明反应达到平衡,故c正确;
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等,反应过程中压强始终不变,不能说明达到平衡,故d错误,
故答案为:bc;
(3)设反应的碘单质物质的量为x
W(s)+I2(g)⇌WI2(g)
起始量(mol) 1 0
变化量(mol) x x
平衡量(mol) 1-x x
K=
| x |
| 1-x |
| 1 |
| 3 |
x=0.25mol
则0-5min内的平均反应速率v(WI2)=
| △c |
| △t |
| ||
| 5min |
平衡时I2(g)的转化率=
| 消耗量 |
| 起始量 |
| 0.25mol |
| 1mol |
反应前后气体物质的量不变,加入碘单质物质的量为原来的2倍,I2的物质的量浓度为原来的2倍,平衡常数随温度变化,浓度增大达到平衡的时间短,最后达到的平衡相同,故选c;
故答案为:0.025mol/(L•min);25%;c;
(4)为提高该反应的反应速率,同时使
| c(I2) |
| c(WI2) |
(5)由图可知,在高温条件下得到纯的W晶体,即升高温度平衡向逆反应方向移动,正反应为放热反应,即△H<0,通过题意温度T2端利于反应正向进行,为低温,温度T1端利于反应向左进行,为高温,所以T1>T2;反应体系中I2可循环使用,
故答案为:>;I2.
看了 利用“化学蒸气转移法”提纯金...的网友还看了以下:
物理化学恒温恒压恒容的问题,请高手帮忙.看了好几本教材后没搞明白.恒温,书上说是T1=T2=T环境 2020-06-17 …
农妇山泉和恒达冰泉会不会破坏原始森林的生态环境?农妇山泉和恒达冰泉都是采集天然原始森林的水它们是不 2020-06-21 …
2010年元旦过后,美国科幻大片《阿凡达》上映。影片讲述地球人试图从遥远的潘多拉星球(其所在的恒星 2020-06-21 …
恒流源、电阻、恒压源3个元件并联,求各元件功率,并说明是产生还是消耗?并验证是否平衡.恒压源上正下 2020-06-23 …
形容旺盛的,源源不断的,财源广进的,永恒的词语或成语同时能够表达以上意思的. 2020-07-08 …
用“看上去好像实际上”造句.例句:我们看的见的星星,绝大多数是恒星.看上去他们好像是冷的,但... 2020-07-22 …
中国山东省烟台市开发区泰山路1号恒达大厦本人急需翻译上面地址,请那位先生帮忙! 2020-11-13 …
下列关于恒星的颜色、温度与亮度的关系说法正确的是()A.恒星看上去越亮,温度越偏向蓝色B.恒星看上去 2020-12-15 …
下列关于恒星的颜色、温度与亮度的关系说法正确的是()A.恒星看上去越亮,温度越偏向蓝色B.恒星看上去 2020-12-15 …
等效平衡中,恒温恒容时.△n不等于零,为什么要研究不管怎么加只要满足元素守恒达到平衡时就相同这种情况 2020-12-22 …