早教吧作业答案频道 -->化学-->
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI)酸盐的形式存在.有开采价值的钨矿石之一白钨矿的主要成分是CaWO4,含有二氧化硅、氧化铁
题目详情
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在.有开采价值的钨矿石之一白钨矿的主要成分是CaWO4,含有二氧化硅、氧化铁等杂质,工业冶炼钨流程如下:
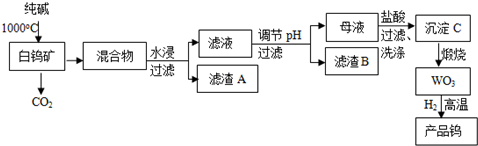
已知:
①钨酸酸性很弱,难溶于水
②完全沉淀离子的pH值:SiO32-为8,WO42-为5
③碳和金属钨在高温下会反应生成碳化钨
(1)74W在周期表的位置是第___周期.
(2)CaWO4与纯碱发生的化学反应方程式是___.
(3)滤渣B的主要成分是(写化学式)___.调节pH可选用的试剂是:___(填写字母序号).
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)母液中加入盐酸的离子方程式为___.检验沉淀C是否洗涤干净的操作是___.
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是___.
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4)=1×10-10,
Ksp[Ca(OH)2]=4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中
=___.

已知:
①钨酸酸性很弱,难溶于水
②完全沉淀离子的pH值:SiO32-为8,WO42-为5
③碳和金属钨在高温下会反应生成碳化钨
(1)74W在周期表的位置是第___周期.
(2)CaWO4与纯碱发生的化学反应方程式是___.
(3)滤渣B的主要成分是(写化学式)___.调节pH可选用的试剂是:___(填写字母序号).
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)母液中加入盐酸的离子方程式为___.检验沉淀C是否洗涤干净的操作是___.
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是___.
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4)=1×10-10,
Ksp[Ca(OH)2]=4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中
c(W
| ||
| c(OH-) |
▼优质解答
答案和解析
白钨矿的主要成分是CaWO4,含有二氧化硅、氧化铁等杂质,白钨矿与碳酸钠在1000℃温度下反应,二氧化硅与碳酸钠会反应生成硅酸钠,氧化铁不反应,得到的混合物用水浸取,过滤后的滤液经过系列操作得到WO3,说明碳酸钠与CaWO4反应生成Na2WO4,则滤渣A为氧化铁等,滤液中含有Na2SiO3、Na2WO4,再调节pH在5~8之间,使硅酸根转化为H2SiO3沉淀过滤除去,母液中含有Na2WO4,再加入盐酸得到沉淀C为H2WO4,灼烧产生三氧化钨和水,再还原得到钨.
(1)由74-2-8-8-18-32=6,可钨处于第六周期,
故答案为:六;
(2)CaWO4与纯碱反应生成Na2WO4、CaO与二氧化碳,反应方程式为:CaWO4+Na2CO3
Na2WO4+CaO+CO2↑,
故答案为:CaWO4+Na2CO3
Na2WO4+CaO+CO2↑;
(3)滤渣B的主要成分为H2SiO3,调节溶液pH使硅酸根转化为H2SiO3沉淀过滤除去,应加入盐酸,
故答案为:H2SiO3;C;
(4)母液中Na2WO4与盐酸得到H2WO4沉淀与氯化钠,反应离子方程式为:WO42-+2H+=H2WO4↓;检验沉淀C是否洗涤干净的操作是:取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀
生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净,
故答案为:WO42-+2H+=H2WO4↓;取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净;
(5)如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨,
不容易获得纯的金属钨,用氢气作还原剂可避免产生以上问题,
故答案为:碳或氢气都可置换出钨,但碳为固体,难以分离,且碳和金属钨在高温下会反应生成碳化钨;
(6)当溶液中WO42-恰好沉淀完全,其离子浓度等于10-5mol/L,根据Ksp(CaWO4)=c(Ca2+)×c(WO4-)=1×10-10,则溶液中c(Ca2+)=1×10-5mol/L,再根据Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=4×10-7,可知c(OH-)=0.2mol/L,则溶液中
=
=5×10-5,
故答案为:5×10-5.
(1)由74-2-8-8-18-32=6,可钨处于第六周期,
故答案为:六;
(2)CaWO4与纯碱反应生成Na2WO4、CaO与二氧化碳,反应方程式为:CaWO4+Na2CO3
| ||
故答案为:CaWO4+Na2CO3
| ||
(3)滤渣B的主要成分为H2SiO3,调节溶液pH使硅酸根转化为H2SiO3沉淀过滤除去,应加入盐酸,
故答案为:H2SiO3;C;
(4)母液中Na2WO4与盐酸得到H2WO4沉淀与氯化钠,反应离子方程式为:WO42-+2H+=H2WO4↓;检验沉淀C是否洗涤干净的操作是:取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀
生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净,
故答案为:WO42-+2H+=H2WO4↓;取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净;
(5)如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨,
不容易获得纯的金属钨,用氢气作还原剂可避免产生以上问题,
故答案为:碳或氢气都可置换出钨,但碳为固体,难以分离,且碳和金属钨在高温下会反应生成碳化钨;
(6)当溶液中WO42-恰好沉淀完全,其离子浓度等于10-5mol/L,根据Ksp(CaWO4)=c(Ca2+)×c(WO4-)=1×10-10,则溶液中c(Ca2+)=1×10-5mol/L,再根据Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=4×10-7,可知c(OH-)=0.2mol/L,则溶液中
c(W
| ||
| c(OH-) |
| 10-5 |
| 0.2 |
故答案为:5×10-5.
看了 钨是我国丰产元素,是熔点最高...的网友还看了以下:
用化学方程式说明问题:(1)用氢氧化钠溶液吸收含有二氧化硫废气:.(2)洁厕精是含有盐酸的洗涤剂, 2020-04-06 …
下列关于氧气的说法,不正确的是()A.氧气用于炼钢,目的之一是除去生铁中多余的碳和其他杂质B.空气 2020-05-13 …
用化学用语填空:(1)氧气.(2)含氧质量分数最高的氧化物.(3)标出硝酸铵中氮元素的化合价−3N 2020-05-13 …
用化学符号填空:(1)形成酸雨的主要气体;(2)铅笔芯的主要成分;(3)红宝石的主要成分是氧化铝, 2020-05-14 …
(2011•揭阳模拟)请用化学用语填空:(1)揭阳市是全国有名的玉都,宝石的主要化学成分为氧化铝,绿 2020-11-12 …
九年级化学计算题铝土矿的主要成分是三氧化二铝,在三氧化二铝中,铝元素与氧元素的质量比是9:8,170 2021-01-21 …
我国古代n纺织业常用氢氧化钾作漂洗n洗涤剂.前人将贝壳(主要成分是碳酸钙)灼烧后n固体与草木灰(主要 2021-01-22 …
用化学用语填空:氧气、木炭、一氧化碳、二氧化碳、甲烷(1)能使带火星木条复燃的气体是;(2)能用于灭 2021-01-22 …
用化学方程式表示.(1)乙醇可以做内燃机的燃料.(2)用硫酸铜溶液作催化剂,分解过氧化氢制氧气.(3 2021-02-01 …
用化学用语填空:①电解水负极得到的气体是;②调味用的食盐的主要成分是;③铁在潮湿的空气中会生锈,铁锈 2021-02-09 …