早教吧作业答案频道 -->化学-->
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.反应原理为:(g)+HCl(g)⇌ClCH
题目详情
2-氯乙醇是一种重要的有机化工原料,受热时易分解.通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇.制取反应装置如图所示.
反应原理为: (g)+HCl(g)⇌ClCH2CH2OH(l)△H<0
(g)+HCl(g)⇌ClCH2CH2OH(l)△H<0
部分实验药品及物理量:
制取与测定实验步骤如下:
Ⅰ.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;②分别将氯化氢与环氧乙烷两种气体按6:5(物质的量)的配比通入反应器中,使其在溶剂中充分溶解反应;③反应温度控制在30℃,持续反应100min;④采用减压蒸馏,收集产品.
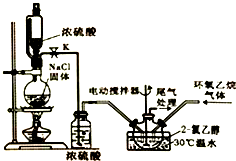
(1)装置中使用恒压分液漏斗的优点是___.
(2)在步骤④中,采用减压分馏的原因是___.
(3)写出实验步骤中提高环氧乙烷利用率的措施:___、___.(写出两点)
Ⅱ.2-氯乙醇含量的测定.
已知:①ClCH2CH2OH+NaOH
HOCH2CH2OH+NaCl(水解反应)
②Ksp(AgCl)=1.8×10-30;Ksp(AgSCN)=1.0×10-12
③经检测,所得样品中还含有一定量的氯化氢和其它杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1.
样品中Cl元素含量的测定,涉及的实验步骤如下:
a.待完全水解后加稀硝酸至酸性;
b.加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
c.取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;
d.向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
e.加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;
f.另取样品1.00mL加水稀释成10.00mL,用pH计测定,测得溶液的pH为1.00.
(4)在上述实验步骤a-e中,
①合理的操作顺序是___.(选填序号)
②操作d加入硝基苯的目的是___,若无此操作,则所测样品中Cl元素含量将会___.(填“偏大”、“偏小”或“不变”)
③操作e选用的指示剂可以是下列的___.(选填序号)
A.淀粉溶液 B.酚酞溶液 C.NH4Fe(SO4)2溶液 D.FeCl2溶液
(5)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为___.
(6)2-氯乙醇能否与水反应生成HCl?请设计实验验证:___.
反应原理为:
 (g)+HCl(g)⇌ClCH2CH2OH(l)△H<0
(g)+HCl(g)⇌ClCH2CH2OH(l)△H<0部分实验药品及物理量:
| 化合物名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) |
| 环氧乙烷 | 44 | -112,2 | 10.8 |
| 2-氯乙醇 | 80.5 | -67.5 | 128.8 |
Ⅰ.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;②分别将氯化氢与环氧乙烷两种气体按6:5(物质的量)的配比通入反应器中,使其在溶剂中充分溶解反应;③反应温度控制在30℃,持续反应100min;④采用减压蒸馏,收集产品.

(1)装置中使用恒压分液漏斗的优点是___.
(2)在步骤④中,采用减压分馏的原因是___.
(3)写出实验步骤中提高环氧乙烷利用率的措施:___、___.(写出两点)
Ⅱ.2-氯乙醇含量的测定.
已知:①ClCH2CH2OH+NaOH
| △ |
| |
②Ksp(AgCl)=1.8×10-30;Ksp(AgSCN)=1.0×10-12
③经检测,所得样品中还含有一定量的氯化氢和其它杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g•mL-1.
样品中Cl元素含量的测定,涉及的实验步骤如下:
a.待完全水解后加稀硝酸至酸性;
b.加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;
c.取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;
d.向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;
e.加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;
f.另取样品1.00mL加水稀释成10.00mL,用pH计测定,测得溶液的pH为1.00.
(4)在上述实验步骤a-e中,
①合理的操作顺序是___.(选填序号)
②操作d加入硝基苯的目的是___,若无此操作,则所测样品中Cl元素含量将会___.(填“偏大”、“偏小”或“不变”)
③操作e选用的指示剂可以是下列的___.(选填序号)
A.淀粉溶液 B.酚酞溶液 C.NH4Fe(SO4)2溶液 D.FeCl2溶液
(5)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为___.
(6)2-氯乙醇能否与水反应生成HCl?请设计实验验证:___.
▼优质解答
答案和解析
(1)使用恒压分液漏斗可确保漏斗液面上方压强和烧瓶内气体压强相等,使漏斗内液体顺利流下,故答案为:平衡气压,使分液漏斗内的液体能顺利滴下;
(2)因为2-氯乙醇高温下易分解,可通过减压蒸馏的方法,降低其沸点,防分解,故答案为:减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解;
(3)可通过增大氯化氢的量或降温(控制反应温度控制在30℃)等方法促进平衡正向移动,提高环氧乙烷的利用率,故答案为:氯化氢过量;反应温度控制在30℃;
(4)①为样品中Cl元素含量的测定,可通过先取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;待完全水解后加稀硝酸至酸性;然后加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;再向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;最后加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;故答案为:cabde;
②防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,滴NH4SCN溶液前可加入硝基苯使沉淀表面被有机物覆盖,如果不进行此操作,则会有AgCl部分电离,消耗的NH4SCN溶液偏多,导致样品中氯元素的含量偏小,
故答案为:防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀;偏小;
③可利用溶液里Fe3+来检验NH4SCN溶液是否过量,现象是当溶液显血红色时可知滴定终点,故答案为:C;
(5)样品中含有HCl的物质的量为:0.1mol/L×0.01L=0.001mol;总AgNO3的物质的量为0.4mol/L×0.0325L=0.013mol;滴定消耗NH4SCN的物质的量为0.1mol/L×0.01L=0.001mol;则样品中氯原子的物质的量为:0.013mol-0.001mol-0.001mol=0.011mol;样品中氯元素的质量分数为:
×100%=80.5%,
故答案为:80.5%;
(6)欲证明2-氯乙醇与水反应生成氯化氢,可通过取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应,
故答案为:取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应.
(2)因为2-氯乙醇高温下易分解,可通过减压蒸馏的方法,降低其沸点,防分解,故答案为:减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解;
(3)可通过增大氯化氢的量或降温(控制反应温度控制在30℃)等方法促进平衡正向移动,提高环氧乙烷的利用率,故答案为:氯化氢过量;反应温度控制在30℃;
(4)①为样品中Cl元素含量的测定,可通过先取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;待完全水解后加稀硝酸至酸性;然后加入32.50mL0.400mol•L-1AgNO3溶液,使Cl-完全沉淀;再向其中加入2.00mL硝基苯(密度:1.21g•mL-1),振荡,使沉淀表面被有机物覆盖;最后加入指示剂,用0.100mol•L-1NH4SCN溶液滴定过量Ag+至终点,消耗NH4SCN溶液10.00mL;故答案为:cabde;
②防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,滴NH4SCN溶液前可加入硝基苯使沉淀表面被有机物覆盖,如果不进行此操作,则会有AgCl部分电离,消耗的NH4SCN溶液偏多,导致样品中氯元素的含量偏小,
故答案为:防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀;偏小;
③可利用溶液里Fe3+来检验NH4SCN溶液是否过量,现象是当溶液显血红色时可知滴定终点,故答案为:C;
(5)样品中含有HCl的物质的量为:0.1mol/L×0.01L=0.001mol;总AgNO3的物质的量为0.4mol/L×0.0325L=0.013mol;滴定消耗NH4SCN的物质的量为0.1mol/L×0.01L=0.001mol;则样品中氯原子的物质的量为:0.013mol-0.001mol-0.001mol=0.011mol;样品中氯元素的质量分数为:
| 0.011mol×80.5g/mol |
| 1mL×1.1g/mL |
故答案为:80.5%;
(6)欲证明2-氯乙醇与水反应生成氯化氢,可通过取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应,
故答案为:取少量2-氯乙醇于试管中,加水溶解,振荡后滴加硝酸银溶液,观察是否有白色沉淀,如有,则表明2-氯乙醇能与水发生反应,否则,不会反应.
看了 2-氯乙醇是一种重要的有机化...的网友还看了以下:
万有引力常量适应于任何两个物体,引力常量的普适性成了万有引力定律正确性的最早证据。引力常量G不仅有 2020-05-13 …
下列常用词语中字音有错误的一组是A.氛围fēn肤浅fū敷衍塞责fūyǎnsè准噶尔gáB.大动千戈 2020-07-02 …
万有引力常量适应于任何两个物体,引力常量的普适性成了万有引力定律正确性的最早证据.引力常量G不仅有 2020-07-11 …
如图所示,A-G是初中化学常见的七种物质.图中“→”表示转化关系,“-”表示相互能反应.F可以用于 2020-07-20 …
工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).(1)在一定温度和压强下,CO( 2020-07-21 …
依据事实,写出下列反应的热化学方程式.(1)1molN2(g)与适量H2(g)起反应,生成NH3(g 2021-02-16 …
依据事实,写出下列反应的热化学方程式.(1)1molN2(g)与适量H2(g)起反应生成NH3(g) 2021-02-16 …
书写热化学方程式:A.1molN2(g)与适量O2(g)起反应,生成NO2(g),吸收68kJ热量. 2021-02-16 …
(1)请用热化学方程式表示:A.1molN2(g)与适量H2(g)起反应,生成2molNH3(g), 2021-02-16 …
依据事实,写出下列反应的热化学方程式.(1)1molN2(g)与适量H2(g)起反应生成NH3(g) 2021-02-16 …