早教吧作业答案频道 -->化学-->
NaOH溶液可用于多种气体的处理.(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,写出CO32-第一步水解的离子方程式.已知25℃时
题目详情
NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,写出CO32-第一步水解的离子方程式___.已知25℃时,CO32-第一步水解的平衡常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=20:1 时,溶液的pH=___.
②泡沫灭火器中通常装有NaHCO溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式___.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmol•L-1CH3COONa溶液,则两份溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为___(已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1).可使溶液A和溶液B的 pH相等的方法是___.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收.吸收SO2的过裎中,溶液中H2SO3、HSO3-、SO32-三者所占物质的量分数(a)随pH变化的关系如图所示:
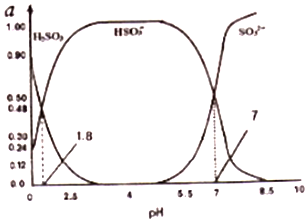
①图中pH=7时,溶液中离子浓度关系正确的是___.
A.c(Na+)>2c(SO32-)>c(HSO3-)
B.c(Na+)=c(SO32- )+c(HSO3-)+c(H2SO3)
C.c(OH-)=c(H+)+c(H2SO3)+c(HSO3-)
D.c(Na+)>c(HSO3-)>c(SO32- )>c(H+)=c(OH-)
②利用上图中数据,求反应H2SO3=2H++SO32-的平衡常数的数值___.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,写出CO32-第一步水解的离子方程式___.已知25℃时,CO32-第一步水解的平衡常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=20:1 时,溶液的pH=___.
②泡沫灭火器中通常装有NaHCO溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式___.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmol•L-1CH3COONa溶液,则两份溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为___(已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1).可使溶液A和溶液B的 pH相等的方法是___.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收.吸收SO2的过裎中,溶液中H2SO3、HSO3-、SO32-三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是___.
A.c(Na+)>2c(SO32-)>c(HSO3-)
B.c(Na+)=c(SO32- )+c(HSO3-)+c(H2SO3)
C.c(OH-)=c(H+)+c(H2SO3)+c(HSO3-)
D.c(Na+)>c(HSO3-)>c(SO32- )>c(H+)=c(OH-)
②利用上图中数据,求反应H2SO3=2H++SO32-的平衡常数的数值___.
▼优质解答
答案和解析
(1)①CO32-水解而使其水溶液呈碱性,写出CO32-第一步水解的离子方程式为:CO32-+H2O⇌HCO3-+OH-,水解常数Kh=
&;)=2×10-4,当溶液中c(HCO3-):c(CO32-)=20:1时,c(OH-)=10-5mol/L,由水的离子积Kw可知,c(H+)=10-9mol/L,所以pH=-lg10-9=9,
故答案为:CO32-+H2O⇌HCO3-+OH-;9;
②Al2(SO4)3与NaHCO3混合时能相互促进水解生成氢氧化铝沉淀、二氧化碳气体,离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑;
(2)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量浓度为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液;
HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,溶液B碱性大于A溶液,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-),
A.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,故正确;
B.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节溶液pH相等,故错误;
C.溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液pH更大,故错误;
D.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,故正确;
故答案为:c(NO3-)>c(NO2-)>c(CH3COO-);AD;
(3)①A、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),所以c(Na+)>2c(SO32-),而图可知pH=7时,c(SO32-)=c(HSO3-),则c(Na+)>2c(SO32-)>c(HSO3-),故A 正确;
B、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),c(SO32-)≠c(H2SO3),故B错误;
C、pH=7时,c(H+)=c(OH-),故C错误;
D、SO32-+H2O⇌HSO3-+OH-,HSO3-⇌H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)=c(SO32-)>c(H+)=c(OH-),故D错误;故答案为:A;
②亚硫酸的第一步电离方程式为:H2SO3⇌H++HSO3-,根据图象可知,pH=0时,亚硫酸浓度为0.9mol/L,亚硫酸氢根离子浓度为0.24mol/L,此时氢离子浓度为1mol/L,则Ka1=
≈0.27,故答案为:0.27.
c(HC
| ||
c(C
|
故答案为:CO32-+H2O⇌HCO3-+OH-;9;
②Al2(SO4)3与NaHCO3混合时能相互促进水解生成氢氧化铝沉淀、二氧化碳气体,离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑;
(2)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量浓度为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液;
HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,溶液B碱性大于A溶液,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-),
A.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,故正确;
B.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节溶液pH相等,故错误;
C.溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液pH更大,故错误;
D.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,故正确;
故答案为:c(NO3-)>c(NO2-)>c(CH3COO-);AD;
(3)①A、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),所以c(Na+)>2c(SO32-),而图可知pH=7时,c(SO32-)=c(HSO3-),则c(Na+)>2c(SO32-)>c(HSO3-),故A 正确;
B、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),c(SO32-)≠c(H2SO3),故B错误;
C、pH=7时,c(H+)=c(OH-),故C错误;
D、SO32-+H2O⇌HSO3-+OH-,HSO3-⇌H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)=c(SO32-)>c(H+)=c(OH-),故D错误;故答案为:A;
②亚硫酸的第一步电离方程式为:H2SO3⇌H++HSO3-,根据图象可知,pH=0时,亚硫酸浓度为0.9mol/L,亚硫酸氢根离子浓度为0.24mol/L,此时氢离子浓度为1mol/L,则Ka1=
| 0.24×1 |
| 0.9 |
看了 NaOH溶液可用于多种气体的...的网友还看了以下:
化学计算题.羧算和醇有一元羧酸和一元醇形成第酯A.燃烧7.4克A,可得5.4克水和6.72L(标准 2020-04-26 …
如图所示是有关二氧化碳的性质实验:(1)实验序号实验现象实验结论:AB(2)由试验A可得出二氧化碳 2020-05-13 …
因式分解a3(b-c)+b3(c-a)+c3(a-b)如果用待定系数法解,得a3(b-c)+b3( 2020-05-16 …
根据方程组2x+a=23y-1=a,可得出用含x的式子表示y的形式是 2020-06-03 …
某工人运50个花瓶规定完整的运一个到目的地可得运费10元损坏一个要倒赔10元运完这批花瓶后他得到运 2020-06-07 …
依据人民调解委员会组织条例的规定,人民调解委员会根据当事人的申请及时调解纠纷,当事人没有申请的A. 2020-06-12 …
2010年世界杯足球赛中,甲、乙、丙、丁四支队分在同一小组,在小组赛中,这四支队中都要与另三队各赛 2020-06-14 …
《战国策·齐策一:邹忌讽齐王纳谏》记载:齐威王接受大臣邹忌建议纳谏:“所有能够当面指责我的过错的, 2020-06-18 …
修改病句:今年六月起,凡是超产20%以上的,可得一等奖,凡是超产20%一下的,可得二等奖上面打错两 2020-06-19 …
A+足量的H2SO4可得B(部分生成产物略)A+足量的H2SO4可得B,B加X为C,C加X为D,D 2020-06-26 …