早教吧作业答案频道 -->化学-->
学完中和反应的知识后,某化学兴趣小组的同学在老师的指导下,对酸碱反应过程,溶液温度变化及如何判断酸碱溶液恰好完全反应进行了进一步的探究,请你参与.探究活动一酸碱反
题目详情
学完中和反应的知识后,某化学兴趣小组的同学在老师的指导下,对酸碱反应过程,溶液温度变化及如何判断酸碱溶液恰好完全反应进行了进一步的探究,请你参与.
【探究活动一】酸碱反应过程中溶液的温度变化室温下,取10份相同体积100%NaOH溶液于10支试管中,分别滴加一定体积10%盐酸,并测定溶液温度的最高值.记录数据如下:
(1)写出氢氧化钠与盐酸反应的化学方程式___.
(2)由溶液温度的变化可知,氢氧化钠与盐酸反应___(选填“放出”或“吸收”)热量.
(3)从实验记录的数据看,氢氧化钠完全反应时,加入盐酸的体积是在___mL(填体积范围)之间的某一数值;当加盐酸的体积在12-20mL之间,溶液温度下降,其原因之一是___.
【探究活动二】如何判断盐酸与氢氧化钠溶液恰好完全反应
(4)甲同学提出:可用酸碱指示剂进行判断.
根据化学实验中“反应现象必须明显”的设计原则:你认为要判断酸碱溶液恰好完全反应,应该选用___(选填“石蕊”或“酚酞”)试液作指示剂.
具体的操作是:___.
(5)乙同学提出:可通过测定实验过程中溶液酸碱度的变化进行判断.
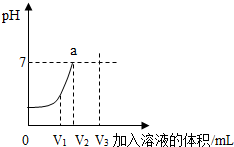
如图是某同学通过多次测定溶液的pH,画出的曲线,请你回答:
①该实验是将___滴加到另一溶液中,图中a点表示___.
②当加入溶液的体积为V1mL时,溶液中所含的溶质有___(填化学式);
③滴加的NaOH溶液体积为V3mL时,溶液的pH___7(选填“小于”、“等于”或“大于”).
【探究活动一】酸碱反应过程中溶液的温度变化室温下,取10份相同体积100%NaOH溶液于10支试管中,分别滴加一定体积10%盐酸,并测定溶液温度的最高值.记录数据如下:
| 加入盐酸体积/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度/℃ | 25.2 | 28.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
(2)由溶液温度的变化可知,氢氧化钠与盐酸反应___(选填“放出”或“吸收”)热量.
(3)从实验记录的数据看,氢氧化钠完全反应时,加入盐酸的体积是在___mL(填体积范围)之间的某一数值;当加盐酸的体积在12-20mL之间,溶液温度下降,其原因之一是___.
【探究活动二】如何判断盐酸与氢氧化钠溶液恰好完全反应
(4)甲同学提出:可用酸碱指示剂进行判断.
根据化学实验中“反应现象必须明显”的设计原则:你认为要判断酸碱溶液恰好完全反应,应该选用___(选填“石蕊”或“酚酞”)试液作指示剂.
具体的操作是:___.
(5)乙同学提出:可通过测定实验过程中溶液酸碱度的变化进行判断.
如图是某同学通过多次测定溶液的pH,画出的曲线,请你回答:
①该实验是将___滴加到另一溶液中,图中a点表示___.
②当加入溶液的体积为V1mL时,溶液中所含的溶质有___(填化学式);
③滴加的NaOH溶液体积为V3mL时,溶液的pH___7(选填“小于”、“等于”或“大于”).

▼优质解答
答案和解析
【探究活动一】
【解释与结论】(1)氢氧化钠和盐酸反应的化学方程式为:NaOH+HCl=NaCl+H2O
(2)由溶液温度的变化可知,氢氧化钠与盐酸反应是放热的.故填:放出.
(3)从实验记录的数据看,加入氢氧化钠的体积为8-10mL之间时,温度还在升高,加入氢氧化钠的体积为10-12mL之间时,溶液的温度有了呈下降的趋势,故氢氧化钠完全反应时,加入盐酸的体积是在8-12mL之间.当加盐酸的体积在12-20mL之间,溶液温度下降,可能原因是反应完全后,加入盐酸起到冷却的作用,故其原因之一是自然冷却.
【探究活动二】
(4)甲同学提出:可用酸碱指示剂进行判断.
根据化学实验中“反应现象必须明显”的设计原则:判断酸碱溶液恰好完全反应:氢氧化钠溶液呈碱性,故酚酞为红色,恰好完全反应时溶液呈中性,故酚酞为无色,石蕊试液在碱性溶液中为蓝色,石蕊在中性溶液中为紫色,当恰好完全反应时的颜色变化不明显,故选用酚酞.
具体的操作是:往滴有酚酞试液的氢氧化钠溶液逐滴加入盐酸溶液,溶液由红色逐渐变成无色.
(5)乙同学提出:可通过测定实验过程中溶液酸碱度的变化进行判断.
如图中的曲线,测定溶液的PH可以使用PH试纸,图中a点当滴加的NaOH溶液体积为V2mL时,PH为7,表明溶液为中性;滴加的NaOH溶液体积为V3mL时,氢氧化钠过量,溶液呈碱性,其PH>7,故:
①该实验是将氢氧化钠溶液滴加到另一溶液中,图中a点表示当加入溶液的体积为V2时,pH=7,说明盐酸与氢氧化钠恰好完全反应,溶液呈中性.
②当加入溶液的体积为V1mL时,溶液中所含的溶质有NaCl和HCl;
③滴加的NaOH溶液体积为V3mL时,溶液的pH大于7.
故答案为:
(1)NaOH+HCl═NaCl+H2O;(2)放出;
(3)8-12; 自然冷却(或加入常温下的盐酸起到冷却作用);
(4)酚酞; 往滴有酚酞试液的氢氧化钠溶液逐滴加入盐酸溶液,溶液由红色逐渐变成无色;
(5)①氢氧化钠溶液,当加入溶液的体积为V2时,pH=7,说明盐酸与氢氧化钠恰好完全反应,溶液呈中性;②NaCl和HCl; ③大于
【解释与结论】(1)氢氧化钠和盐酸反应的化学方程式为:NaOH+HCl=NaCl+H2O
(2)由溶液温度的变化可知,氢氧化钠与盐酸反应是放热的.故填:放出.
(3)从实验记录的数据看,加入氢氧化钠的体积为8-10mL之间时,温度还在升高,加入氢氧化钠的体积为10-12mL之间时,溶液的温度有了呈下降的趋势,故氢氧化钠完全反应时,加入盐酸的体积是在8-12mL之间.当加盐酸的体积在12-20mL之间,溶液温度下降,可能原因是反应完全后,加入盐酸起到冷却的作用,故其原因之一是自然冷却.
【探究活动二】
(4)甲同学提出:可用酸碱指示剂进行判断.
根据化学实验中“反应现象必须明显”的设计原则:判断酸碱溶液恰好完全反应:氢氧化钠溶液呈碱性,故酚酞为红色,恰好完全反应时溶液呈中性,故酚酞为无色,石蕊试液在碱性溶液中为蓝色,石蕊在中性溶液中为紫色,当恰好完全反应时的颜色变化不明显,故选用酚酞.
具体的操作是:往滴有酚酞试液的氢氧化钠溶液逐滴加入盐酸溶液,溶液由红色逐渐变成无色.
(5)乙同学提出:可通过测定实验过程中溶液酸碱度的变化进行判断.
如图中的曲线,测定溶液的PH可以使用PH试纸,图中a点当滴加的NaOH溶液体积为V2mL时,PH为7,表明溶液为中性;滴加的NaOH溶液体积为V3mL时,氢氧化钠过量,溶液呈碱性,其PH>7,故:
①该实验是将氢氧化钠溶液滴加到另一溶液中,图中a点表示当加入溶液的体积为V2时,pH=7,说明盐酸与氢氧化钠恰好完全反应,溶液呈中性.
②当加入溶液的体积为V1mL时,溶液中所含的溶质有NaCl和HCl;
③滴加的NaOH溶液体积为V3mL时,溶液的pH大于7.
故答案为:
(1)NaOH+HCl═NaCl+H2O;(2)放出;
(3)8-12; 自然冷却(或加入常温下的盐酸起到冷却作用);
(4)酚酞; 往滴有酚酞试液的氢氧化钠溶液逐滴加入盐酸溶液,溶液由红色逐渐变成无色;
(5)①氢氧化钠溶液,当加入溶液的体积为V2时,pH=7,说明盐酸与氢氧化钠恰好完全反应,溶液呈中性;②NaCl和HCl; ③大于
看了 学完中和反应的知识后,某化学...的网友还看了以下:
英语翻译试运转最低起动压力内泄漏量有杆控无杆控耐压试验外泄漏全行程试验额定压力增益工作方式选择修正 2020-05-13 …
小明同学要研究声音的响度是否与振幅有关,应如何去探究?请你帮他设计这次实验的全过程.要求:写出所需 2020-05-13 …
钢轨探伤的题目,某超声波探伤仪,0°探头满刻度声程为250mm,探测60kg/m钢轨时正常螺孔波的 2020-06-25 …
非常急,我会加40分的小明要探究声音的响度是否与振幅有关,应如何去探究?请你帮他设计这次实验的全过 2020-07-11 …
他们是如何描述和影响物体运动的?物体的速度是矢量,他包括线速度和角速度,线速度是单位时间路程的改变 2020-07-30 …
用MAPGIS如何量取直线距离?请教各位前辈,用MAPGIS如何量取直线距离。如量取勘探线的长度, 2020-08-01 …
请问如何可以使酒店房间中的烟雾探测器无法工作.当然并不是破坏,如果破坏,酒店的securityag 2020-08-04 …
下面的题目正确过程我已经知道,所以不必具体回答,只是我不明白为什么这个不是等压变化过程,非得用理想气 2020-12-07 …
中国古代的学者首先发现雪花的结晶是六角形的几何体,但却没有人去深究每一个角之间的关系,更没有从几何学 2020-12-29 …
在探究“功与物体速度变化”的实验中,通过打点计时器打下的纸带来测定小车加速过程中获得的平均速度为.. 2021-01-29 …