某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列说法错误的是()A.Q点消耗氨水溶液的体积等于HCl溶液的
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
说法错误的是( )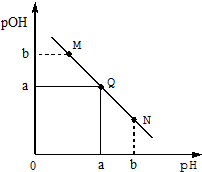
A. Q点消耗氨水溶液的体积等于HCl溶液的体积
B. M点所示溶液导电能力弱于Q点
C. M点和N点所示溶液中水的电离程度相同
D. N点所示溶液中c(NH4+)>c(OH-)
B.由于盐酸为强酸,溶液中完全电离,离子浓度大,M点溶液的导电能力大,Q点是中性溶液,铵根离子与氯离子浓度相同,M和Q点中氯离子的物质的量相同,但Q点的溶液的体积大于M点,所以Q点的导电能力小于M点,故B错误;
C.由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故C正确;
D.由图象可知N点时pH>pOH,说明c(OH-)>c(H+),溶液呈碱性,由电荷守恒可知c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D正确;
故选AB.
宝宝发烧手脚冰凉要注意 暗示体温将会继续上升 2020-03-30 …
图甲是一支常见体温计的示意图,其示数为℃.体温计的测量结果比实验用温度计更精确,但因液柱太细难以读 2020-04-07 …
如图甲所示,温度计的示数为℃.图乙是一支常见体温计的截面示意图,因液柱太细难以读数,所以体温计具有 2020-07-10 …
蜥蜴、家燕、青蛙都是我们常见的动物.关于图中这三种动物共同点(M)的叙述,正确的是()A.M可以表示 2020-11-13 …
四位同学在测量自己的体温时分别沿A、B、C、D(见图a)方向观察读数.其中沿方向观察易于读数,这是因 2020-11-18 …
两支体温计原来示数均为37.5℃,如果不用手拿着他们的上部用力向下甩,就用来测量体温为36℃和38. 2020-11-23 …
(2009•莆田)在防范甲型H1N1流感疫情中,体温计发挥了重要作用.体温计是根据水银的性质制成的, 2020-12-18 …
如图甲中体温计的示数是℃.水银液柱较细难以读数,因此体温计做成外有凸起的弧形玻璃面,横截面如图乙所示 2020-12-25 …
体温计的量程是℃,图甲中体温计的示数是℃.水银液柱较细难以读数,因此体温计做成外有凸起的弧形玻璃面, 2020-12-25 …
如图中圆圈表示三种生物本身具有的特点,重合部分则表示它们的共同特点,下列有关叙述正确的是()A.E可 2020-12-25 …