室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是()A.三种酸的电离常数关系:KHA>KHB>KHDB.滴定至P点
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )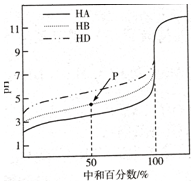
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)
B.中和50%即P点,溶液中溶质为等物质的量浓度的酸(HB)和盐(NaB),由图可知溶液呈酸性,则c(H+)>c(OH-),且酸的电离程度大于酸根离子水解程度,
①NaB完全电离:NaB=Na++B-,这一步的c(B-)=c(Na+),
②HB少部分电离:HB⇌H++B-,则c(HB)>c(H+),
③NaB少部分水 B-+H2O⇌HB+OH-,
由于酸的电离程度大于盐的水解程度,则HB电离产生的B-相对NaB水解消耗的B-多,所以c(B-)>c(Na+),由于HB电离消耗得多,水解生成的HB少,
所以c(Na+)>c(HB),则c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故B错误;
C.当pH=7时,根据电荷守恒三种溶液中离子浓度关系为:
c(Na+)+c(H+)=c(A-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(A-),
c(Na+)+c(H+)=c(B-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(B-),
c(Na+)+c(H+)=c(D-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(D-),
由于三种酸根的水解程度不同,则溶液呈中性时所消耗的氢氧化钠的体积不相同,则三种溶液中钠离子浓度不同,c(A-)、c(B-)、c(D-)也不同,故C错误;
D.恰好中和时,三种溶液所消耗的氢氧化钠体积相同,生成三种盐的浓度相同,混合后溶液因盐的水解呈碱性,质子守恒的关系为:c(OH-)=c(HA)+c(HB)+c(HD)+c(H+),故D错误;
故选:A.
下列说法正确的是()A.配制一定物质的量浓度的溶液,向量筒加水至液面离刻度线1~2cm时,改用胶头 2020-04-12 …
下列基本实验操作中,不合理的是()A.配制一定物质的量浓度溶液,向容量瓶加水至离刻度线1~2cm时 2020-05-14 …
用0.1mol/LNaOH溶液滴定0.1mol/L盐酸,如达到滴定的终点时,不慎多加了1滴NaOH 2020-05-15 …
用0.1mol/L 氢氧化钠滴定0.1mol/L 盐酸溶液,如达到滴定终点不慎多加了一滴氢氧化钠溶 2020-05-16 …
沉淀转化在2ml0.1mol/L的AgNO3溶液中先滴入3-4滴0.1mol/L的NaCl溶液,再 2020-06-04 …
已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeC 2020-07-18 …
用0.1mol/L氢氧化钠滴定0.1mol/L盐酸溶液,如达到滴定终点不慎多加了一滴氢氧化钠溶液(一 2020-10-31 …
物体是由分子组成的,分子有一定大小,可用法粗略测定.在测分子直径的实验中,若油酸酒精溶液的浓度是1: 2020-12-25 …
物体是由分子组成的,分子有一定大小,可用法粗略测定.在测分子直径的实验中,若油酸酒精溶液的浓度是1: 2020-12-25 …
物体是由分子组成的,分子有一定大小,可用法粗略测定.在测分子直径的实验中,若油酸酒精溶液的浓度是1: 2020-12-25 …