早教吧作业答案频道 -->化学-->
硅是信息产业、太阳能电池光电转化的基础材料.锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如图:(1)焦炭在过程Ⅰ中作剂.(2)过程Ⅱ中的Cl2用电解
题目详情
硅是信息产业、太阳能电池光电转化的基础材料.锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如图:
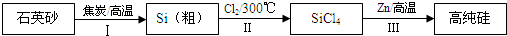
(1)焦炭在过程Ⅰ中作___剂.
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是___.
(3)整个制备过程必须严格控制无水.
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是___.
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中.冷却的作用是___.
(4)Zn还原SiCl4的反应如下:
反应1:400℃~756℃,SiCl4(g)+2Zn(l)⇌Si(s)+2ZnCl2(l)△H1<0
反应2:756℃~907℃,SiCl4(g)+2Zn(l)⇌Si(s)+2ZnCl2(g)△H2<0
反应3:907℃~1410℃,SiCl4(g)+2Zn(g)⇌Si(s)+2ZnCl2(g)△H3<0
①对于上述三个反应,下列说法合理的是___.
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
②实际制备过程选择“反应3”,选择的理由是___.
③已知Zn(l)═Zn(g)△H=+116KJ/mol.若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出___kJ的热量.
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层.腐蚀剂常用稀HNO3和HF的混合液.硅表面首先形成SiO2,最后转化为H2SiF6.用化学方程式表示SiO2转化为H2SiF6的过程___.
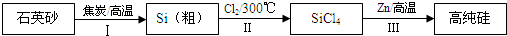
(1)焦炭在过程Ⅰ中作___剂.
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是___.
(3)整个制备过程必须严格控制无水.
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是___.
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中.冷却的作用是___.
(4)Zn还原SiCl4的反应如下:
反应1:400℃~756℃,SiCl4(g)+2Zn(l)⇌Si(s)+2ZnCl2(l)△H1<0
反应2:756℃~907℃,SiCl4(g)+2Zn(l)⇌Si(s)+2ZnCl2(g)△H2<0
反应3:907℃~1410℃,SiCl4(g)+2Zn(g)⇌Si(s)+2ZnCl2(g)△H3<0
①对于上述三个反应,下列说法合理的是___.
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
②实际制备过程选择“反应3”,选择的理由是___.
③已知Zn(l)═Zn(g)△H=+116KJ/mol.若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出___kJ的热量.
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层.腐蚀剂常用稀HNO3和HF的混合液.硅表面首先形成SiO2,最后转化为H2SiF6.用化学方程式表示SiO2转化为H2SiF6的过程___.
▼优质解答
答案和解析
(1)在SiO2+2C
Si+2CO↑中,碳元素化合价升高,被氧化,做还原剂,故答案为:还原剂;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,方程式:2NaCl+2H2O 通电
2NaOH+Cl2↑+H2↑;
故答案为:2NaCl+2H2O 通电
2NaOH+Cl2↑+H2↑;
(3)①四氯化硅与水反应生成二氧化硅和氯化氢,化学方程式:SiCl4+2H2O═SiO2+4HCl;
故答案为:SiCl4+2H2O═SiO2+4HCl;
②将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中,可使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量,
故答案为:使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(4)①通过热化学方程式可知,对于三个反应的反应热都是△H<0表示,都是放热反应,
a.升高温度,平衡向吸热的方向移动,所以会降低SiCl4的转化率,故a错误;
b.Si遇氧气在高温的条件下反应生成二氧化硅,所以还原过程需在无氧的气氛中进行,b正确;
c.有气体参加的反应,增大压强,能加快反应的速率,对于三个反应,都有气体参与,所以增大压强,能提高反应的速率,故c正确;
d.Na、Mg都是还原性比较强的金属,可以代替Zn还原SiCl4,故d正确;
故选:b c d;
②反应2与反应1比较,反应2产物为固体和气体比反应1更易于分离,反应3与反应2比较,反应物都为气态,温度高,反应速率更快,所以实际制备过程选择“反应3”,温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率,
故答案为:温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率;
③每投入1mol SiCl4,有2molZn参加反应,“反应3”与“反应2”比较,反应2中锌为液态,根据Zn(l)═Zn(g)△H=+116KJ/mol,若SiCl4的转化率均为90%,“反应3”比“反应2”多放出116KJ/mol×2×90%=208.8KJ,
故答案为:208.8;
(5)二氧化硅和氢氟酸:SiO2+4HF=SiF4↑+2H2O;SiF4+2HF=H2SiF6,所以用稀HNO3和HF的混合液,硅表面首先形成SiO2,最后转化为H2SiF6的化学方程式为SiO2+6HF═H2SiF6+2H2O,
故答案为:SiO2+6HF═H2SiF6+2H2O.
| ||
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,方程式:2NaCl+2H2O 通电
| ||
故答案为:2NaCl+2H2O 通电
| ||
(3)①四氯化硅与水反应生成二氧化硅和氯化氢,化学方程式:SiCl4+2H2O═SiO2+4HCl;
故答案为:SiCl4+2H2O═SiO2+4HCl;
②将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中,可使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量,
故答案为:使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(4)①通过热化学方程式可知,对于三个反应的反应热都是△H<0表示,都是放热反应,
a.升高温度,平衡向吸热的方向移动,所以会降低SiCl4的转化率,故a错误;
b.Si遇氧气在高温的条件下反应生成二氧化硅,所以还原过程需在无氧的气氛中进行,b正确;
c.有气体参加的反应,增大压强,能加快反应的速率,对于三个反应,都有气体参与,所以增大压强,能提高反应的速率,故c正确;
d.Na、Mg都是还原性比较强的金属,可以代替Zn还原SiCl4,故d正确;
故选:b c d;
②反应2与反应1比较,反应2产物为固体和气体比反应1更易于分离,反应3与反应2比较,反应物都为气态,温度高,反应速率更快,所以实际制备过程选择“反应3”,温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率,
故答案为:温度高反应速率快;与前两个反应比较更易于使硅分离使化学平衡向右移动提高转化率;
③每投入1mol SiCl4,有2molZn参加反应,“反应3”与“反应2”比较,反应2中锌为液态,根据Zn(l)═Zn(g)△H=+116KJ/mol,若SiCl4的转化率均为90%,“反应3”比“反应2”多放出116KJ/mol×2×90%=208.8KJ,
故答案为:208.8;
(5)二氧化硅和氢氟酸:SiO2+4HF=SiF4↑+2H2O;SiF4+2HF=H2SiF6,所以用稀HNO3和HF的混合液,硅表面首先形成SiO2,最后转化为H2SiF6的化学方程式为SiO2+6HF═H2SiF6+2H2O,
故答案为:SiO2+6HF═H2SiF6+2H2O.
看了 硅是信息产业、太阳能电池光电...的网友还看了以下:
李明家电能表的情况如图所示,它2500r/kw`h只接一个电器工作,6min电能表转过30r那么这个 2020-03-30 …
∫(右上角是2,右下角是1)e^xdx我有可能说的不清楚可能大家有点不大理解可能会因为我没说清楚大家 2020-03-31 …
什么是新型能源战略顺便回答下:1)世界上各国新能源上有哪些主要措施2)我国对新能源的政策是什么3) 2020-05-13 …
某有机物M与氢气加成的产物是(的如3)2的如的如2O如,则有关M的说法正确的是()A.M的分子式为 2020-05-14 …
对如下的三个命题:1.边长为连续整数的直角三角形是存在的2.边长为连续整数的锐角三角形是存在的3. 2020-05-17 …
无友不如己者,这句话你们是怎样理解的?那天老板开会,无意间提到交朋友,他说交朋友一定要交比自己能力 2020-05-20 …
如何制作一个无底能装水的木桶要求一个至少有一个拳头大的无底无盖木桶要求木桶里能在有重力的情况下让水 2020-05-21 …
高中常考有机化学官能团的强弱顺序强弱就是指哪一种官能团能决定该有机物的名称,如一种化合物中官能团只 2020-05-23 …
《“能吞能吐”的森林》说明文阅读理解"能吞能吐"的森林森林涵养水源,保持水土,防止水旱灾害的作用非 2020-06-04 …
生物实验显微镜如何快速准确的对光实验步骤是对的但是总是对不到明亮的光,怎么样才能快速的找到光源对光 2020-06-11 …