早教吧作业答案频道 -->化学-->
锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如图:(1)1mol焦炭在过程Ⅰ中失去mol电子.(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为
题目详情
锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如图:
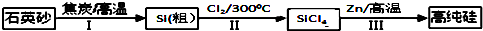
(1)1mol焦炭在过程Ⅰ中失去___mol电子.
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为___.
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为___.
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为___.
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中.冷却的作用是___.
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)═Si(s)+2ZnCl2(g)△H<0下列说法正确的是___
A.还原过程需在无氧的气氛中进行 B.投入1molZn可生成14g还原产物
C.增加SiCl4(g)的量,该反应平衡常数不变D.若SiCl4(g)过量可增大△H的值
(6)有一种由硅制作的材料中常加入Ag2SO4,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4 的Ksp=___;(两位有效数字)
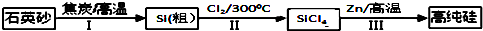
(1)1mol焦炭在过程Ⅰ中失去___mol电子.
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为___.
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为___.
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为___.
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中.冷却的作用是___.
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)═Si(s)+2ZnCl2(g)△H<0下列说法正确的是___
A.还原过程需在无氧的气氛中进行 B.投入1molZn可生成14g还原产物
C.增加SiCl4(g)的量,该反应平衡常数不变D.若SiCl4(g)过量可增大△H的值
(6)有一种由硅制作的材料中常加入Ag2SO4,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4 的Ksp=___;(两位有效数字)
▼优质解答
答案和解析
(1)过程I中发生反应:SiO2+2C
Si+2CO↑,反应中碳元素化合价由0价升高为+2价,1mol焦炭在过程Ⅰ中失去2mol电子,故答案为:2;
(2)电解氯化钠溶液生成氢氧化钠、氯气和氢气,电解离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-
,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(3)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH-6e-+8OH-=CO32-+7H2O,故答案为:CH3OH-6e-+8OH-=CO32-+7H2O;
(4)①SiCl4遇水剧烈水解生成SiO2和一种酸,根据原子守恒可知该酸为HCl,反应方程式为:SiCl4+2H2O=SiO2+4HCl,故答案为:SiCl4+2H2O=SiO2+4HCl;
②将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中,可使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量,
故答案为:使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(5)A.Zn、Si在高温条件下都能与氧气反应,所以还原过程需在无氧的气氛中进行,故A正确
B.反应属于可逆反应,投入的Zn不能完全反应,投入1molZn生成还原产物Si的质量小于14g,故B错误;
C.平衡常数只受温度影响,增加SiCl4(g)的量,该反应平衡常数不变,故C正确;
D.焓变△H与热化学方程式中SiCl4的物质的量有关,与SiCl4的用量无关,故D错误,
故选:AC;
(6)令水的质量为100g,则Ag2SO4的质量为0.624g,则n(Ag2SO4)=
=2×10-3mol,溶液的质量约100.624g,溶液密度约是水的密度,故溶液体积约为100.624ml≈0.1L,则Ag2SO4的物质的量浓度为2×10-2mol/L,c(SO42-)=2×10-2mol/L,c(Ag+)=4×10-2mol/L,则Ksp(Ag2SO4)=c2(Ag+)•c(SO42-)=2×10-2×(4×10-2)2=3.2×10-5,
故答案为:3.2×10-5.
| ||
(2)电解氯化钠溶液生成氢氧化钠、氯气和氢气,电解离子方程式为:2Cl-+2H2O
| ||
,故答案为:2Cl-+2H2O
| ||
(3)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH-6e-+8OH-=CO32-+7H2O,故答案为:CH3OH-6e-+8OH-=CO32-+7H2O;
(4)①SiCl4遇水剧烈水解生成SiO2和一种酸,根据原子守恒可知该酸为HCl,反应方程式为:SiCl4+2H2O=SiO2+4HCl,故答案为:SiCl4+2H2O=SiO2+4HCl;
②将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中,可使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量,
故答案为:使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(5)A.Zn、Si在高温条件下都能与氧气反应,所以还原过程需在无氧的气氛中进行,故A正确
B.反应属于可逆反应,投入的Zn不能完全反应,投入1molZn生成还原产物Si的质量小于14g,故B错误;
C.平衡常数只受温度影响,增加SiCl4(g)的量,该反应平衡常数不变,故C正确;
D.焓变△H与热化学方程式中SiCl4的物质的量有关,与SiCl4的用量无关,故D错误,
故选:AC;
(6)令水的质量为100g,则Ag2SO4的质量为0.624g,则n(Ag2SO4)=
| 0.624g |
| 312g/mol |
故答案为:3.2×10-5.
看了 锌还原四氯化硅是一种有着良好...的网友还看了以下:
下列是生活中常见的一些变化,其中属于化学变化的是()A.天热吃冰糕时,发现雪糕慢慢融化B.把木炭放 2020-05-13 …
炭雕是一种集观赏、空气净化于一体的工艺品,其主要成分是木炭.下列说法中错误的是()A.将炭雕的下脚 2020-06-19 …
下列是生活中常见的一些变化,其中属于化学变化的是()A.天热吃雪糕时,发现雪糕慢慢熔化B.把木炭放 2020-06-21 …
下列生活里的常见现象中,一定涉及化学变化的是()A.放在衣柜里的樟脑丸逐渐变小B.冰箱中放入木炭后 2020-06-27 …
下列生活中的常见现象,一定涉及化学变化的是[]A.放在衣柜里的樟脑球逐渐变小B.冰箱中放入木炭后, 2020-06-27 …
(2011•海门市二模)下列生活里常见现象中,一定没有涉及化学变化的是()A.点燃酒精加热火锅B. 2020-06-27 …
《天工开物》中有关炼铁方法的记载是“凡炉中炽铁用炭,煤炭居十七,木炭居十三.凡山林无煤之处,锻工先 2020-06-30 …
某化学兴趣小组采用微型实验装置(如图)探究木炭与氧化铜的实验.提出问题木炭与CuO反应所得红色固体 2020-07-29 …
下图为“我国局部地区示意图”,读图完成下列各题。小题1:图示地区煤炭资源的开采可能直接A.加剧水土流 2020-12-17 …
“低碳生活”是当今社会所倡导的绿色生活方式,木炭的热值是3.4×107J/kg.利用太阳能将2000 2020-12-31 …